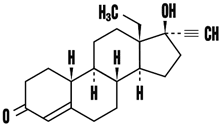
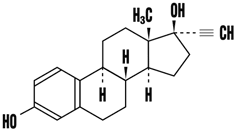
1
Farquhar,C.et al.:Cochrane Database Syst.Rev.2017;5(5):CD006109
2
Kolb,K,H.et al.:未発表
3
第十七改正日本薬局方解説書.廣川書店;2016.C3824-3827
4
第十七改正日本薬局方解説書.廣川書店;2016.C865-868
5
古谷 博他:臨床評価.1978;6(1):15-28
6
Swyer,G.I.M.et al.:J.Reprod.Fertil.1968;5(Suppl.5):63-68
7
Edgren,R.A.et al.:Steroid.1963;2(3):319-335