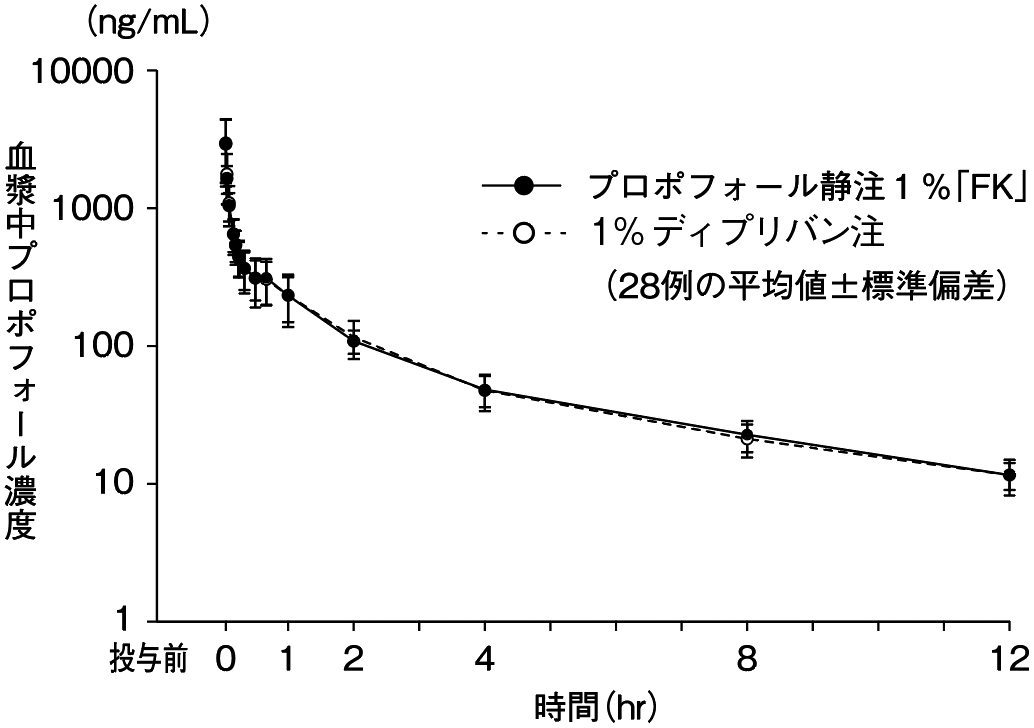
1
Parke TJ, et al.:BMJ. 1992;305(6854):613-616
2
Bennett SN, et al.:N Engl J Med. 1995;333(3):147-154
3
新宮興ほか:麻酔. 1990;39:219および685
4
Kay NH, et al.:Br J Anaesth. 1986;58:1075-1079
5
社内資料:プロポフォール静注1%20mL「FK」、プロポフォール静注1%50mL「FK」及びプロポフォール静注1%100mL「FK」生物学的同等性に関する資料概要
6
Kirkpatrick T, et al.:Br J Anaesth. 1988;60:146-150
7
中尾正和ほか:麻酔と蘇生. 1993;29(1):77-81
8
Servin F, et al.:Anesthesiology. 1993;78:657-665
9
Morcos WE, et al.:Postgrad Med J. 1985;61(Suppl.3):62-63
10
Ickx B, et al.:Br J Anaesth. 1998;81:854-860
11
Servin F, et al.:Anesthesiology. 1988;69:887-891
12
Servin F, et al.:Br J Anaesth. 1990;65:177-183
13
釘宮豊城ほか:麻酔と蘇生. 1993;29(1):3-10
14
風間富栄ほか:麻酔と蘇生. 1993;29(1):11-21
15
村川雅洋ほか:麻酔と蘇生. 1993;29(1):23-32
16
釘宮豊城ほか:麻酔と蘇生. 1993;29(1):33-43
17
盛生倫夫ほか:麻酔と蘇生. 1993;29(1):45-56
18
真下節ほか:麻酔と蘇生. 1993;29(1):57-67
19
磨田裕ほか:麻酔と蘇生. 1996;32(2):95-103
20
妙中信之ほか:麻酔と蘇生. 1996;32(2):105-114
21
Glen JB.:Br J Anaesth. 1980;52:731-742
22
Tomoda K, et al.:Br J Anaesth. 1993;71:383-387