1
門間和夫 他:小児科の進歩2(診断と治療社)1983;95-101〔SYK000835〕
2
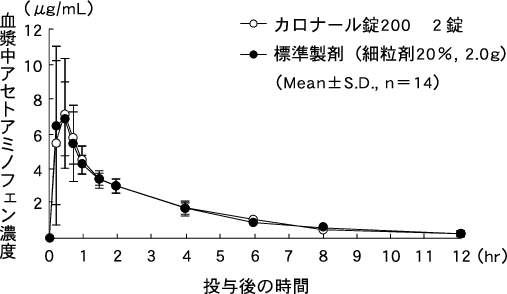
あゆみ製薬(株)社内資料:カロナール錠200の生物学的同等性試験
3
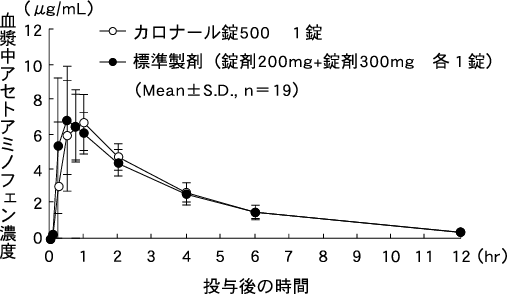
あゆみ製薬(株)社内資料:カロナール錠500の生物学的同等性試験
4
大西明弘 他:基礎と臨床 1993;27(11):4310-4321〔SYK000122〕
5
Zapater, P.et al.:Aliment Pharmacol Ther.2004;20(1):29-36〔SYK010993〕
6
あゆみ製薬(株)社内資料:カロナール錠300の生物学的同等性試験
7
扇内秀樹 他:基礎と臨床 1996;30(7):1785-1790〔SYK000813〕
8
三木 亮 他:基礎と臨床 1996;30(7):1773-1777〔SYK010691〕
9
牛嶋 久:基礎と臨床 1996;30(7):1779-1784〔SYK000837〕
10
鈴木孝浩:ペインクリニック 2012;33(2):218-226〔SYK012768〕