作成又は改訂年月
日本標準商品分類番号
薬効分類名
承認等
販売名
アシクロビル点滴静注液250mg「日医工」
販売名コード
承認・許可番号
22900AMX00048000
Aciclovir
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱等に表示の使用期限内に使用すること
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1管中
アシクロビル
250mg/10mL
添加物
pH調節剤
製剤の性状
剤形・性状
水性注射液
無〜微黄色澄明
pH
10.0〜11.0注)
浸透圧比
約1注)
(生理食塩液に対する比)
注:250mg/100mL生理食塩液における値
禁忌
本剤の成分あるいはバラシクロビル塩酸塩に対し過敏症の既往歴のある患者
効能又は効果
単純ヘルペスウイルス及び水痘・帯状疱疹ウイルスに起因する下記感染症
免疫機能の低下した患者(悪性腫瘍・自己免疫疾患など)に発症した単純疱疹・水痘・帯状疱疹
脳炎・髄膜炎
新生児単純ヘルペスウイルス感染症
用法及び用量
単純ヘルペスウイルス及び水痘・帯状疱疹ウイルスに起因する下記感染症
免疫機能の低下した患者(悪性腫瘍・自己免疫疾患など)に発症した単純疱疹・水痘・帯状疱疹
脳炎・髄膜炎
[成人]
通常,成人にはアシクロビルとして1回体重1kg当たり5mgを1日3回,8時間毎に1時間以上かけて,7日間点滴静注する。
なお,脳炎・髄膜炎においては,必要に応じて投与期間の延長もしくは増量ができる。ただし,上限は1回体重1kg当たり10mgまでとする。
[小児]
通常,小児にはアシクロビルとして1回体重1kg当たり5mgを1日3回,8時間毎に1時間以上かけて,7日間点滴静注する。
なお,必要に応じて増量できるが,上限は1回体重1kg当たり20mgまでとする。
さらに,脳炎・髄膜炎においては,投与期間の延長もできる。
新生児単純ヘルペスウイルス感染症
通常,新生児にはアシクロビルとして1回体重1kg当たり10mgを1日3回,8時間毎に1時間以上かけて,10日間点滴静注する。
なお,必要に応じて投与期間の延長もしくは増量ができる。ただし,上限は1回体重1kg当たり20mgまでとする。
<注射液の調製法>
投与量に相当する量を1アンプル当たり100mL以上の補液で希釈する(用時調製)。
用法及び用量に関連する使用上の注意
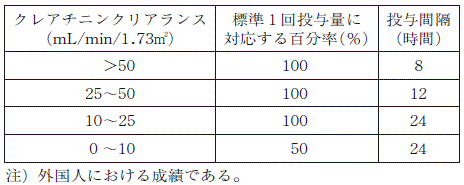
腎障害のある患者又は腎機能の低下している患者,高齢者では,精神神経系の副作用があらわれやすいので,投与間隔を延長するか又は減量するなど注意すること。なお,本剤の投与間隔及び減量の標準的な目安は下表のとおりである(参考)
注)(「慎重投与」,「重要な基本的注意」,「高齢者への投与」及び「過量投与」の項参照)。
使用上の注意
慎重投与
腎障害のある患者[精神神経症状等があらわれやすい(「用法・用量に関連する使用上の注意」及び「重要な基本的注意」の項参照)。]
肝障害のある患者[肝障害が増悪するおそれがある。]
高齢者[精神神経症状等があらわれやすい(「用法・用量に関連する使用上の注意」,「重要な基本的注意」及び「高齢者への投与」の項参照)。]
重要な基本的注意
点滴静注によってのみ投与すること。
本剤の投与は,発病初期に近いほど効果が期待できるので,早期に投与を開始することが望ましい。
本剤の曝露量が増加した場合には,精神神経症状や腎機能障害が発現する危険性が高い。腎障害のある患者又は腎機能が低下している患者,高齢者においては,本剤の投与間隔及び投与量を調節し,患者の状態を観察しながら慎重に投与すること。なお,一般に精神神経症状は本剤の投与中止により回復する(「用法・用量に関連する使用上の注意」及び「過量投与」の項参照)。
腎障害のある患者又は腎機能が低下している患者,高齢者等の脱水症状をおこしやすいと考えられる患者では,本剤の投与中は適切な水分補給を行うこと(「高齢者への投与」の項参照)。
意識障害等があらわれることがあるので,自動車の運転等,危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。なお,腎機能障害患者では,特に意識障害等があらわれやすいので,患者の状態によっては従事させないよう注意すること(「用法・用量に関連する使用上の注意」の項参照)。
相互作用
併用注意
注:特に腎機能低下の可能性がある患者(高齢者等)には慎重に投与すること。
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| プロベネシド | 本剤の排泄が抑制され,本剤の平均血漿中半減期が18%延長し,平均血漿中濃度曲線下面積が40%増加するとの報告がある。注) | プロベネシドは尿細管分泌に関わるOAT1及びMATE1を阻害するため,本剤の腎排泄が抑制されると考えられる。 |
| シメチジン | アシクロビルの排泄が抑制され,アシクロビルの平均血漿中濃度曲線下面積が27%増加するとの報告がある(バラシクロビル塩酸塩でのデータ)。注) | シメチジンは尿細管分泌に関わるOAT1,MATE1及びMATE2-Kを阻害するため,アシクロビルの腎排泄が抑制されると考えられる。 |
| ミコフェノール酸 モフェチル | 本剤及びミコフェノール酸 モフェチル代謝物の排泄が抑制され,両方の平均血漿中濃度曲線下面積が増加するとの報告がある。注) | 本剤とミコフェノール酸 モフェチル代謝物が尿細管分泌で競合すると考えられる。 |
| テオフィリン | 本剤との併用によりテオフィリンの中毒症状があらわれることがある。 | 機序は不明であるが,本剤がテオフィリンの代謝を阻害するためテオフィリンの血中濃度が上昇することが考えられる。 |
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
次のような症状があらわれることがあるので,観察を十分に行い,異常が認められた場合には,投与を中止するなど適切な処置を行うこと。
アナフィラキシーショック,アナフィラキシー(呼吸困難,血管浮腫等)(頻度不明)
汎血球減少,無顆粒球症,血小板減少,播種性血管内凝固症候群(DIC),血小板減少性紫斑病(頻度不明)
*急性腎障害,尿細管間質性腎炎(頻度不明)
精神神経症状(頻度不明)
意識障害(昏睡),せん妄,妄想,幻覚,錯乱,痙攣,てんかん発作,麻痺,脳症等
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN),皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
呼吸抑制,無呼吸(頻度不明)
間質性肺炎(頻度不明)
肝炎,肝機能障害,黄疸(頻度不明)
急性膵炎(頻度不明)
その他の副作用
次のような症状があらわれることがあるので,異常が認められた場合には,減量又は投与を中止するなど適切な処置を行うこと。
| | 頻度不明 |
| 過敏症注) | 発熱,発疹,紅斑,蕁麻疹,そう痒,水疱,固定薬疹,光線過敏症 |
| 血液 | 貧血,紫斑,血小板減少,顆粒球減少,好酸球増多,リンパ球増多,出血,白血球増多,好塩基球増多,リンパ球減少,血小板増多 |
| 肝臓 | 肝機能検査値異常(AST(GOT),ALT(GPT)等の上昇),肝腫大 |
| 腎臓・泌尿器 | BUN上昇,血清クレアチニン値上昇,蛋白尿,血尿,尿円柱,乏尿,膿尿,結晶尿,尿閉,排尿困難 |
| 消化器 | 嘔気,嘔吐,腹痛,胃痛,心窩部痛,胃不快感,下痢,軟便,食欲不振,胃炎,消化不良,舌炎,口渇,便秘,鼓腸放屁 |
| 精神神経系 | 意識障害,傾眠,見当識障害,情動失禁,そう状態,多弁,不安,攣縮,しびれ感,振戦,めまい,眠気,感情鈍麻,うつ状態,集中力障害,徘徊,離人症,興奮,健忘,不眠,言語障害,独語,異常感覚,運動失調,歩行異常,不随意運動,眼振等 |
| 循環器 | 胸痛,頻脈,動悸,血圧上昇,不整脈,血圧低下 |
| 筋骨格 | 関節痛,筋肉痛 |
| 全身症状 | 全身倦怠感,発熱,頭痛,蒼白,ほてり,悪寒,失神,浮腫,脱力感,筋力低下 |
| 適用部位 | 注射部壊死,注射部炎症 |
| その他 | 呼吸困難,血清トリグリセライド値上昇,血清コレステロール値上昇,血清蛋白低下,尿糖,肺炎,咽頭炎,喘鳴,胸水,疼痛,難聴,結膜炎,視力異常,味覚障害,脱毛,発汗,低ナトリウム血症,血清アルブミン低下,AG比低下,血清カリウム値上昇 |
高齢者への投与
本剤は,主として腎臓から排泄されるが,高齢者では腎機能が低下していることが多いため高い血中濃度が持続するおそれがあるので,投与間隔又は投与量を調節し,患者の状態を観察しながら,慎重に投与すること(「用法・用量に関連する使用上の注意」及び「重要な基本的注意」の項参照)。また,本剤の投与中は適切な水分補給を行うこと。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[動物実験(ラット)の妊娠10日目に,母動物に腎障害のあらわれる大量(200mg/kg/day以上)を皮下投与した実験では,胎児に頭部及び尾の異常が認められたと報告されている。]
授乳中の婦人には本剤投与中は授乳を避けさせること。[ヒト母乳中への移行が報告されている。]
過量投与
徴候,症状
本剤の過量投与の場合は,血清クレアチニン及びBUNの上昇に続き腎不全の発現が認められている。また,過量静脈内投与後に,精神神経症状(錯乱,幻覚,興奮,てんかん発作,昏睡等)が認められている。
処置
患者の状態を注意深く観察すること。血液透析により,アシクロビルを血中より効率的に除去することができるので,過量投与により症状が発現した場合は,処置の一つとして血液透析を考慮すること。
適用上の注意
投与時
点滴静注に際し,ときに投与部位の血管痛を訴えたり,血管の脆弱化(血管外へ漏れやすくなる)があらわれることがあるので,薬液が血管外へ漏れないように慎重に投与すること。
調製方法
開封後は速やかに使用し,残液は廃棄すること。なお,補液で希釈する際,補液によっては白濁あるいは結晶が析出する場合があるのでそのような場合には使用しないこと。本品及び希釈溶液を含め,調製溶液の冷却は結晶の析出をまねきやすいので冷却しないこと。
調製時
本剤はアルカリ性を呈し,pH等の変化により配合変化が起こりやすいので,他剤との混注は可能な限り避けること。
アンプルカット時
本剤はワンポイントカットアンプルを使用しているので,アンプル枝部のマークを上にして反対方向に折ること。
なお,アンプルカット時の異物混入を避けるため,カット部をエタノール綿等で清拭し,カットすること。
その他の注意
骨髄小核試験において,高用量(マウス腹腔内投与,180mg/kg以上)で染色体異常の誘発性を疑わせる所見が得られている。
[Ames試験,マウス優性致死試験等では陰性であったが,マウスに180,360,720mg/kgを腹腔内1回投与した骨髄小核試験では,小核出現頻度に用量相関性の有意な増加が認められた。]
高度の肥満を有する女性7例(標準体重の203±20.6%)に5mg/kgを投与したところ標準体重の女性5例(標準体重の96.3±15.4%)に比しアシクロビル血中濃度(Cmax及び投与後12時間値)が約2倍となったが,体重あたりのアシクロビルの全身クリアランス及び分布容積をそれぞれ標準体重で補正した値は両者間に差がなかった。このような高度の肥満患者に本剤を投与する場合には,標準体重に基づいた用量で投与すべきとの報告がある。
薬効薬理
抗ウイルス薬。ヘルペス群ウイルス感染細胞内でウイルス誘導のチミジンキナーゼにより酸化されて活性型のアシクロビル三リン酸となり,ウイルスDNAポリメラーゼを阻害すると共にウイルスのDNAに取り込まれてウイルスのDNA鎖形成を阻害する。正常細胞では活性化を受けないので,正常細胞への毒性は極めて低い。1)
有効成分に関する理化学的知見
一般名
アシクロビル(Aciclovir)
化学名
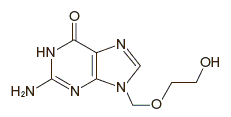
2-Amino-9-[(2-hydroxyethoxy)methyl]-1,9-dihydro-6H-purin-6-one
構造式
分子式
C8H11N5O3
分子量
225.20
性状
白色〜微黄白色の結晶性の粉末である。
水に溶けにくく,エタノール(99.5)に極めて溶けにくい。
0.1mol/L塩酸試液又は希水酸化ナトリウム試液に溶ける。
取扱い上の注意
安定性試験
本品につき加速試験(40℃,6ヵ月)を行った結果,アシクロビル点滴静注液250mg「日医工」は通常の市場流通下において3年間安定であることが推測された。2)
包装
アシクロビル点滴静注液250mg「日医工」
10mL×5管
主要文献及び文献請求先
主要文献
1
第十七改正日本薬局方解説書 C-36,廣川書店,東京(2016)
2
日医工株式会社 社内資料:安定性試験
文献請求先
主要文献に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
製造販売元
日医工株式会社
富山市総曲輪1丁目6番21