1
Kumagai Y, et al.:Bone. 2011;49(5):1101-1107
2
社内資料:閉経後骨粗鬆症患者を対象とした第Ⅱ相臨床試験の薬物動態(2013年3月25日承認、CTD2.7.6.10)
3
社内資料:関節リウマチ患者を対象とした第Ⅱ相臨床試験の薬物動態(2017年7月3日承認、CTD2.7.6.7)
4
社内資料:健康被験者、低骨密度又は骨粗鬆症の閉経後女性及びがん患者におけるデノスマブの母集団薬物動態解析(2013年3月25日承認、CTD2.7.2.3)
5
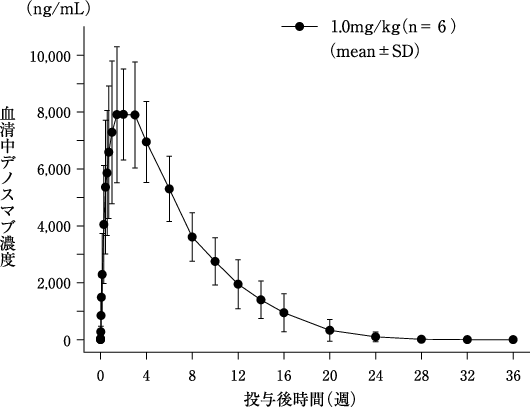
社内資料:125I標識デノスマブを単回皮下投与したカニクイザルにおける分布及び排泄(2013年3月25日承認、CTD2.6.4)
6
社内資料:125I標識デノスマブを単回皮下投与したカニクイザルにおけるQWBA試験(2013年3月25日承認、CTD2.6.4.4)
7
Block GA, et al.:J Bone Miner Res. 2012;27(7):1471-1479
8
社内資料:ビタミンDとカルシウムにて併用治療している原発性骨粗鬆症患者を対象としたデノスマブのプラセボ対照無作為化二重盲検による検証的試験(2013年3月25日承認、CTD2.7.6)
9
社内資料:ビタミンDとカルシウムにて併用治療している関節リウマチ患者を対象としたデノスマブのプラセボ対照無作為化二重盲検による検証的試験(2017年7月3日承認、CTD2.7.6.6)
10
Bone HG, et al.:J Clin Endocrinol Metab. 2011;96(4):972-980
11
社内資料:閉経後骨粗鬆症患者を対象とした海外第Ⅲ相二重盲検試験及びその非盲検継続試験の追跡調査結果
12
Lacey DL, et al.:Cell. 1998;93(2):165-176
13
社内資料:デノスマブのRANKLに対する結合試験(2013年3月25日承認、CTD2.6.2.2)
14
Kostenuik PJ, et al.:J Bone Miner Res. 2009;24(2):182-195
15
Ominsky MS, et al.:Bone. 2011;49(2):162-173
16
Kostenuik PJ, et al.:Bone. 2011;49(2):151-161
17
社内資料:カニクイザルにおけるデノスマブ投与試験(2013年3月25日承認、CTD2.6.2.2)
18
Gerstenfeld LC, et al.:J Bone Miner Res. 2009;24(2):196-208
19
社内資料:ラットコラーゲン誘発関節炎モデルでのOPG-Fcの作用(2017年7月3日承認、CTD2.6.2.2)
20
Stolina M, et al.:J Bone Miner Res. 2005;20(10):1756-1765
21
Stolina M, et al.:Arthritis Res Ther. 2009;11(6):R187