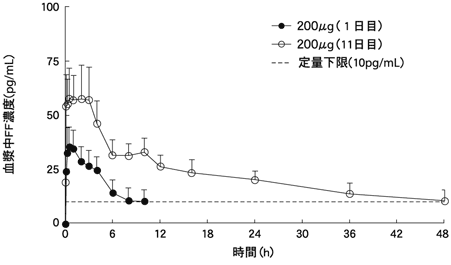
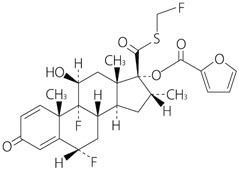
1
Nakahara N,et al.:Int J Clin Pharmacology and Therapeutics.2013;51:660-671
2
Bleecker ER,et al.:J Allergy Clin Immunol Pract.2014;2:553-561
3
O' Byrne PM,et al.:Eur Respir J.2014;43:773-782
4
Adachi M,et al.:Respir Med.2016;120:78-86
5
村木 正人ほか:アレルギー・免疫.2013;20:1496-1511
6
McCormack PL,et al.:Drugs.2007;67:1905-1915