1
宇治康明 他:薬理と治療. 1990;18:S689-S702
2
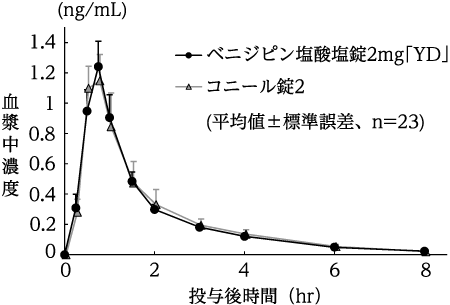
(株)陽進堂社内資料:生物学的同等性試験(錠2mg)
3
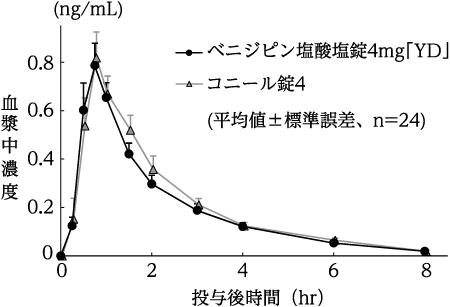
(株)陽進堂社内資料:生物学的同等性試験(錠4mg)
4
小林弘幸 他:薬物動態. 1990;5:71-86
5
小林弘幸 他:薬物動態. 1990;5:103-109
6
Kobayashi, H. et al.:Arzneim-Forsch/Drug Res. 1988;38:1753-1756
7
Kobayashi, H. et al.:Xenobiotica. 1997;27:597-608
8
(株)陽進堂社内資料:生物学的同等性試験(錠8mg)
9
吉永馨 他:薬理と治療. 1990;18:S785-S799
10
吉永馨 他:薬理と治療. 1990;18:S801-S822
11
吉永馨 他:薬理と治療. 1992;20:S3647-S3664
12
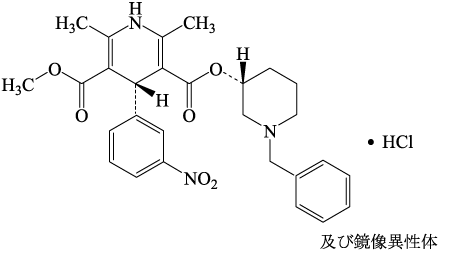
第十八改正 日本薬局方解説書 廣川書店. 2021;C-5219-5223
13
Karasawa, A. et al.:Jan J Pharmacol. 1988;47:35-44
14
Ishii, A. et al.:J Cardiovasc Pharmacol. 1993;21:191-196
15
Karasawa, A. et al.:Arzneim-Forsch/Drug Res. 1988;38:1684-1690
16
Karasawa, A. et al.:Arzneim-Forsch/Drug Res. 1988;38:1695-1697
17
吉永馨 他:薬理と治療. 1990;18:S721-S729
18
Karasawa, A. et al.:Arzneim-Forsch/Drug Res. 1988;38:1702-1707
19
Karasawa, A. et al.:Arzneim-Forsch/Drug Res. 1988;38:1717-1721
20
野田汎史 他:薬理と治療. 1990;18:S843-S850
21
金澤雅之 他:日腎誌. 1990;32:33-44
22
Fuji, Y. et al.:J Cardiovasc Pharmacol. 1988;11:438-443
23
築山久一郎 他:薬理と治療. 1990;18:S713-S719
24
Fukuda, S. et al.:J Cardiovasc Pharmacol. 1988;12:S155-S156










 0120-647-734
0120-647-734

