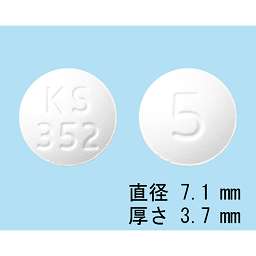
1
健康成人における薬物動態(単回経口投与試験)(アリセプト錠:1999年10月8日承認、申請資料概要ヘ.3.(1).1).①)
2
健康成人における薬物動態(反復経口投与試験)(アリセプト錠:1999年10月8日承認、申請資料概要ヘ.3.(1).1).②)
3
皇漢堂製薬株式会社 社内資料
4
皇漢堂製薬株式会社 社内資料
5
食事の影響(アリセプト錠:1999年10月8日承認、申請資料概要ヘ.3.(2))
6
血漿蛋白質との結合(アリセプト錠:1999年10月8日承認、申請資料概要ヘ.2.(2).4))
7
健康成人における薬物動態(蛋白結合率)(アリセプト錠:1999年10月8日承認、申請資料概要ヘ.3.(1).4))
8
松井賢司ら:薬物動態,2000;15(2):101-111
9
健康成人における薬物動態(代謝及び排泄)(アリセプト錠:1999年10月8日承認、申請資料概要ヘ.3.(1).5))
10
Tiseo,P.et al.:Br.J.Clin.Pharmacol.,1998;46.(S.1):56-60
11
Tiseo,P.et al.:Br.J.Clin.Pharmacol.,1998;46.(S.1):51-55
12
高齢者における薬物動態(アリセプト錠:1999年10月8日承認、申請資料概要ヘ.3.(3))
13
皇漢堂製薬株式会社 社内資料
14
Homma,A.et al.:Dement.Geriatr.Cogn.Disord.,2000;11(6):299-313
15
臨床第Ⅲ相試験(アリセプト錠:1999年10月8日承認、申請資料概要ト.2.(5))
16
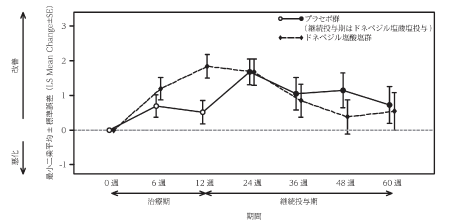
Homma,A.et al.:Dement.Geriatr.Cogn.Disord.,2008;25(5):399-407
17
高度アルツハイマー型認知症を対象とした臨床第Ⅱ相試験(アリセプト錠/D錠/細粒:2007年8月23日承認、審査報告書)
18
レビー小体型認知症を対象とした臨床第Ⅱ相試験(アリセプト錠/細粒/D錠/内服ゼリー/ドライシロップ:2014年9月19日承認、CTD2.7.6.1)
19
Mori,E.et al.:Ann.Neurol.,2012;72(1):41-52
20
Ikeda,M.et al.:Alzheimers Res.Ther.,2015;7(4):1-10
21
山西嘉晴ら:薬理と治療,1998;26(S):S1277-S1282
22
山西嘉晴ら:薬理と治療,1998;26(S):S1283-S1294
23
小笹貴史ら:薬理と治療,1998;26(S):S1303-S1311
24
小倉博雄ら:薬理と治療,1998;26(S):S1313-S1320