1
Bentley JB, et al.:Anesth Analg. 1982;61:968-971
2
社内資料:日本人におけるJNS005の薬物動態の検討
3
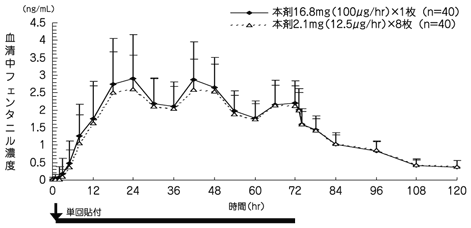
社内資料: JNS005の単回及び反復貼付時の薬物動態の検討
4
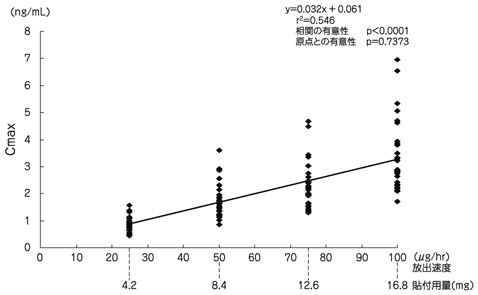
社内資料: JNS005の用量相関性の検討
5
Miyazaki T, et al.:Clin Drug Invest. 2008;28:313-325
6
社内資料: JNS005の民族間及び年齢層間での薬物動態の比較
7
社内資料:フェンタニルパッチの肝障害患者における薬物動態の検討
8
社内資料:JNS005の薬物動態に対する温度の影響の検討
9
社内資料:フェンタニルの薬物動態試験
10
大塚宏之, 他:薬理と治療. 2001;29:865-876
11
Leuschen MP:Clin. Pharmacy. 1990;9:336-337
12
Meuldermans WEG, et al.:Arch Int Pharmacodyn. 1982;257:4-19
13
Feierman DE:Drug Metab Dispos. 1996;24:932-939
14
McClain DA, et al.:Clin Pharmacol. Ther. 1980;28:106-114
15
水口公信, 他:医薬ジャーナル. 2001;37:2389-2402
16
水口公信, 他:医薬ジャーナル. 2001;37:2403-2426
17
社内資料:JNS005の慢性疼痛に対する第Ⅲ相臨床試験(2010年1月20日承認、CTD2.7.6.4)
18
社内資料:JNS005の慢性難治性疼痛に対する臨床試験(2010年1月20日承認、CTD2.7.6.3)
19
社内資料:フェンタニルのオピオイド受容体に対する親和性
20
Maguire P, et al.:Eur J Pharmacol. 1992;213:219-225
21
社内資料:フェンタニルの一般薬理作用
22
塩崎静男, 他:薬理と治療. 2001;29:849-854
23
Vissers K, et al.:Anesth Analg. 2005;101:457-464