1
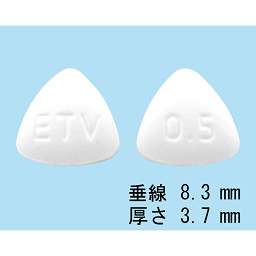
社内資料:生物学的同等性試験
2
エンテカビルの薬物動態に及ぼす高脂肪食又は軽食の影響試験(バラクルード錠:2006年7月26日承認, 申請資料概要2.7.6.2)
3
腎機能障害患者を対象とした薬物動態試験(バラクルード錠:2006年7月26日承認, 申請資料概要2.7.2.2, 2.7.6.2)
4
B型肝炎ウイルスに再感染した肝移植患者におけるエンテカビルの薬物動態の検討(バラクルード錠:2006年7月26日承認, 申請資料概要2.7.2.2, 2.7.6.2)
5
薬物相互作用試験(バラクルード錠:2006年7月26日承認, 申請資料概要2.7.2.2, 2.7.6.2)
6
髙折修二ほか監訳:グッドマン・ギルマン薬理書(第12版), 廣川書店 2013;2101-2102