1
井上良輔ほか:Allergol.Int.,2003;52:213-218
2
中出 進ほか:Drug Metab.Pharmacokinet.,2006;21:133-139
3
PPKモデル及び共変量の影響(オノンドライシロップ:2011年12月22日承認、申請資料概要2.7.2.3)
4
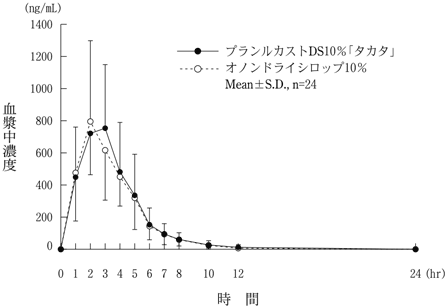
社内資料:生物学的同等性試験(プランルカストDS10%「タカタ」)
5
石堂雅恒ほか:薬物動態,1993;8:49-66
6
松本一郎ほか:現代医療,1999;31(増Ⅳ):2936-2943
7
中島光好ほか:臨床医薬,1993;9(Suppl.1):3-29
8
三河春樹ほか:臨床医薬,1997;13:423-456
9
宮本昭正ほか:医学のあゆみ,1993;164:225-247
10
第Ⅲ相国内二重盲検比較試験(小児)(オノンドライシロップ:2011年12月22日承認、申請資料概要2.5.4.4)
11
若林健一郎ほか:Allergy Asthma Proc.,2012;33:102-109
12
第Ⅱ相国内二重盲検比較試験(小児)(オノンドライシロップ:2011年12月22日承認、申請資料概要2.5.4.4)
13
第Ⅱ相国内二重盲検比較試験(小児)(オノンドライシロップ:2011年12月22日承認、申請資料概要2.7.3.3)
14
第Ⅲ相国内二重盲検比較試験(小児)(オノンドライシロップ:2011年12月22日承認、申請資料概要2.5.4.4)
15
第Ⅲ相国内二重盲検比較試験(小児)(オノンドライシロップ:2011年12月22日承認、申請資料概要2.7.3.3)
16
奥田 稔 ほか:耳鼻と臨床,1998;44:47-72
17
小児の通年性アレルギー性鼻炎に対する有効性(オノンドライシロップ:2011年12月22日承認、審査報告書)
18
国内臨床試験(成人)(オノンカプセル:2000年1月18日承認、申請資料概要ト.2.3)
19
朝倉光司ほか:臨床医薬,1997;13:2951-2973
20
岩田 力:小児科臨床,2009;62:987-1000
21
岩田 力 ほか:日本小児アレルギー学会誌,2009;23:629-642
22
作用機序(オノンカプセル:2000年1月18日承認、申請資料概要ホ.1)
23
小畠隆明ほか:Jpn.J.Pharmacol.,1992;60:227-237
24
藤田 学 ほか:Jpn.J.Pharmacol.,1997;75:355-362
25
竹田博史ほか:薬理と治療,1997;25:373-381
26
効力を裏付ける試験(オノンカプセル:2000年1月18日承認、申請資料概要ホ.1)
27
田村 弦ほか:臨床医薬,1993;9(Suppl.1):217-220
28
中河直樹ほか:Eur.J.Pharmacol.,1993;235:211-219
29
山口哲朗ほか:Am.Rev.Respir.Dis.,1992;146:923-929
30
藤村政樹ほか:Respir.Med.,1993;87:133-138
31
中河直樹ほか:基礎と臨床,1992;26:5251-5254
32
小畠隆明ほか:Life Sci.,1992;51:1577-1583
33
淀縄 聡ほか:日胸疾会誌,1992;30:302-309
34
宮本昭正ほか:医学のあゆみ,1993;164:225-247
35
宮本昭正ほか:臨床医薬,1993;9(Suppl.1):71-107
36
今野昭義ほか:臨床医薬,1997;13:1921-1939
37
藤田 学 ほか:薬理と治療,1997;25:1379-1386
38
抗原誘発鼻腔通気抵抗上昇に対する作用(オノンドライシロップ:2011年12月22日承認、申請資料概要2.6.2.2)
39
LTD4誘発鼻腔通気抵抗上昇に対する作用(オノンドライシロップ:2011年12月22日承認、申請資料概要2.6.2.2)
40
ヒスタミンに対するくしゃみ反応の増強抑制(オノンドライシロップ:2011年12月22日承認、申請資料概要2.6.2.2)