1
高野雄一 他:薬理と治療. 2010: 38(7): 613-620
2
日比紀文 他:薬理と治療. 2007: 35(6): 617-646
3
社内資料:ラット腸管内容物乾燥重量に対するZ-205の作用(承認年月日:2007年4月18日、申請料概要2.4.2)
4
社内資料:ラット腸管内水分重量に対するZ-205の作用(承認年月日:2007年4月18日、申請資料概要2.4.2)
5
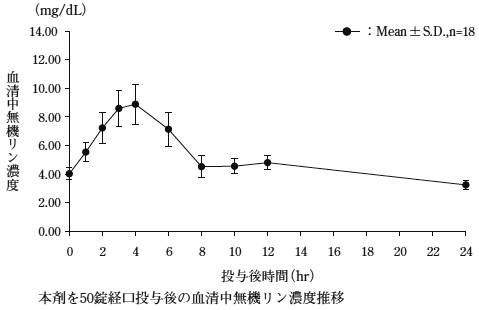
社内資料:イヌにおけるZ-205の腸管洗浄作用(承認年月日:2007年4月18日、申請資料概要2.4.2)