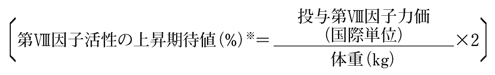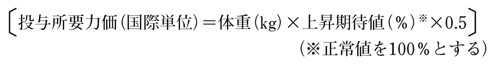添付文書番号
6343406X6040_3_08
企業コード
580842
作成又は改訂年月
日本標準商品分類番号
876343
薬効分類名
血漿分画製剤
承認等
販売名
コンコエイト−HT
販売名コード
販売名英字表記
Conco-eight−HT
販売名ひらがな
こんこえいと−HT
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
一般的名称
乾燥濃縮人血液凝固第VIII因子
特殊記載項目
本剤は、貴重な人血液を原料として製剤化したものである。原料となった血液を採取する際には、問診、感染症関連の検査を実施するとともに、製造工程における一定の不活化・除去処理を実施し、感染症に対する安全対策を講じているが、人血液を原料としていることによる感染症伝播のリスクを完全に排除することはできないため、疾病の治療上の必要性を十分に検討の上、必要最小限の使用にとどめること。
組成・性状
組成
コンコエイト−HT
有効成分 | 血液凝固第VIII因子 血液凝固第VIII因子(F.VIII:C)として 500国際単位 |
|---|
有効成分 | 血液凝固第VIII因子 von Willebrand因子(RCof)として 1,000単位 |
|---|
添加剤 | D-マンニトール 392mg 人血清アルブミン 98mg 水酸化ナトリウム 適量 塩酸 適量 |
|---|
| 添付溶剤 | 日局 注射用水 10mL |
|---|
| 備考 | 血液凝固第VIII因子は、ヒト血液に由来する。
(採血国:日本、採血の区分:献血)
人血清アルブミンは、ヒト血液に由来する。
(採血国:日本、採血の区分:献血) |
|---|
〔1瓶中〕
本剤は、製造工程で、ブタ小腸粘膜由来成分(ヘパリン)を使用している。
製剤の性状
コンコエイト−HT
| pH | 6.5〜8.0※ |
|---|
| 浸透圧比 | 約1※(生理食塩液に対する比) |
|---|
| 性状 | 白色ないし淡黄色の凍結乾燥製剤で、においはない。本剤を添付溶剤で溶解するとき1mL中に血液凝固第VIII因子50国際単位を含有する無色ないし淡黄色の澄明又はわずかに混濁した液剤となる。 |
|---|
効能又は効果
用法及び用量
〈効能共通〉
本剤は製剤に添付された溶解液(日局注射用水)全量で溶解し、緩徐に静脈内に注射又は点滴注入する。なお、1分間に5mLをこえる注射速度は避けること。
〈血友病A〉
通常1回に血液凝固第VIII因子活性(F.VIII:C)で250〜2,000国際単位を投与するが、年齢・症状に応じて適宜増減する。
〈von Willebrand病〉
通常1回にリストセチンコファクター活性(RCof)で500〜4,000単位を投与するが、年齢・症状に応じて適宜増減する。
重要な基本的注意
本剤の使用にあたっては、疾病の治療における本剤の必要性とともに、本剤の製造に際し感染症の伝播を防止するための安全対策が講じられているが、血液を原料としていることに由来する感染症伝播のリスクを完全に排除することができないことを、患者に対して説明し、理解を得るよう努めること。
本剤の原材料となる献血者の血液については、HBs抗原、抗HCV抗体、抗HIV-1抗体、抗HIV-2抗体、抗HTLV-1抗体陰性で、かつALT値でスクリーニングを実施している。更に、HBV、HCV及びHIVについて核酸増幅検査(NAT)を実施し、適合した血漿を本剤の製造に使用しているが、当該NATの検出限界以下のウイルスが混入している可能性が常に存在する。本剤は、以上の検査に適合した血漿を原料として、人血液凝固第VIII因子-vWF複合体を濃縮・精製した製剤であり、ウイルス不活化を目的として、製造工程においてリン酸トリ-n-ブチル(TNBP)/ポリソルベート80処理、凍結乾燥の後、60℃、72時間の加熱処理を施しているが、投与に際しては、次の点に十分注意すること。
血漿分画製剤の現在の製造工程では、ヒトパルボウイルスB19等のウイルスを完全に不活化・除去することが困難であるため、本剤の投与によりその感染の可能性を否定できないので、投与後の経過を十分に観察すること。
肝炎ウイルス等のウイルス感染のリスクについては完全には否定できないので、観察を十分に行い、症状があらわれた場合には適切な処置を行うこと。
現在までに本剤の投与により変異型クロイツフェルト・ヤコブ病(vCJD)等が伝播したとの報告はない。しかしながら、製造工程において異常プリオンを低減し得るとの報告があるものの、理論的なvCJD等の伝播のリスクを完全には排除できないので、投与の際には患者への説明を十分行い、治療上の必要性を十分検討の上投与すること。
大量投与により血管内に凝固による栓塞を起こすおそれがあるので、慎重に投与すること。
患者の血中に血液凝固第VIII因子に対するインヒビターが発生するおそれがある。特に、血液凝固第VIII因子製剤による補充療法開始後、投与回数が少ない時期(補充療法開始後の比較的早期)や短期間に集中して補充療法を受けた時期にインヒビターが発生しやすいことが知られている。本剤を投与しても予想した止血効果が得られない場合には、インヒビターの発生を疑い、回収率やインヒビターの検査を行うなど注意深く対応し、適切な処置を行うこと。
本剤は抗A及び抗B血液型抗体を有する。したがって血液型がO型でない患者に大量投与したとき、まれに溶血性貧血を起こすことがある。
本剤にはフィブリノゲンが含まれているので、投与により血中のフィブリノゲン濃度が過度に上昇するおそれがある。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
IgA欠損症の患者
抗IgA抗体を保有する患者では過敏反応を起こすおそれがある。
溶血性・失血性貧血の患者
ヒトパルボウイルスB19の感染を起こす可能性を否定できない。感染した場合には、発熱と急激な貧血を伴う重篤な全身症状を起こすことがある。
免疫不全患者・免疫抑制状態の患者
ヒトパルボウイルスB19の感染を起こす可能性を否定できない。感染した場合には、持続性の貧血を起こすことがある。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤の投与によりヒトパルボウイルスB19の感染の可能性を否定できない。感染した場合には胎児への障害(流産、胎児水腫、胎児死亡)が起こる可能性がある。
高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
その他の副作用
| 頻度不明 |
|---|
過敏症 | 発熱、蕁麻疹、顔面潮紅等 |
|---|
消化器 | 悪心、嘔吐、腹痛等 |
|---|
精神神経系 | 倦怠感、違和感、頭痛等 |
|---|
注射部位 | 血管痛 |
|---|
その他 | 溶血性貧血、血圧上昇、悪寒、腰痛、季肋部不快感、結膜の充血 |
|---|
適用上の注意
薬剤調製時の注意
他の製剤と混注しないこと。
溶解した液を注射器に移す場合、フィルターの付いたセットを用いること。
一度溶解したものは1時間以内に使用すること。
使用後の残液は細菌汚染のおそれがあるので使用しないこと。本剤は細菌の増殖に好適なたん白であり、しかも保存剤が含有されていない。
薬剤投与時の注意
溶解時に沈殿の認められるものは使用しないこと。
輸注速度が速すぎるとチアノーゼ、動悸を起こすことがあるので、1分間に5mLを超えない速度でゆっくり注入すること。
薬剤交付時の注意
子供の手の届かない所へ保管すること。
使用済の医療機器等の処理については、主治医の指示に従うこと。
薬物動態
血中濃度
血友病A患者12例及びvon Willebrand病患者5例を対象に本剤50国際単位/kgを目安として静脈内に単回投与した国内臨床試験において、本剤の生体内回収率、血中半減期は次のとおりであった, 。
病型 | 症例数 | パラメーター | 生体内回収率(%) | 血中半減期(時間) |
血友病A | 12 | F.VIII:C | 92.8※ | 15.0※ |
von Willebrand病 | 5 | RCof | 102 | 19.3 |
| IIA型 | 2 | 73.1 | 31.2 |
IIB型 | 1 | 200 | 16.4 |
IIC型 | 1 | 96.5 | 7.3 |
III型 | 1 | 68.8 | 10.6 |
※生体内回収率は、投与開始前3日以内に他の第VIII因子濃縮製剤を投与した2例を除外して算出した。血中半減期については、この2例に加え、投与8時間後に溶血のため高値となった1例を除外して算出した。
臨床成績
有効性及び安全性に関する試験
〈血友病A〉
国内臨床試験
血友病A患者12例を対象とした試験において、本剤を静脈内に単回投与し、うち11例について出血時の止血効果を多回投与により3ヵ月間にわたり検討した。その結果、99回の出血に対して、有効率99.0%であった。また、全12例に副作用は認められなかった 。
〈von Willebrand病〉
国内臨床試験
von Willebrand病患者5例を対象とした試験において、本剤を静脈内に単回投与し、このうち3例について出血時の止血効果を多回投与により6ヵ月にわたり検討した。その結果、11回の出血に対し、著効9回、有効2回であった。また、全5例に副作用は認められなかった 。
薬効薬理
作用機序
血漿中の血液凝固第VIII因子及びvon Willebrand因子を補い、出血傾向を抑制する。
血液凝固反応
第VIII因子欠乏血漿を用いたin vitro実験において、本剤の添加量に依存して、活性化部分トロンボプラスチン時間(APTT)の補正効果が確認されている。
また、von Willebrand因子欠乏血漿を用いたin vitro実験において、本剤の添加量に依存して、リストセチンコファクター活性が補正され、同時にマルチマーも補正されることが確認されている 。
取扱い上の注意
本剤は特定生物由来製品に該当することから、本剤を投与又は処方した場合は、医薬品名(販売名)、その製造番号(ロット番号)、投与又は処方した日、投与又は処方を受けた患者の氏名、住所等を記録し、少なくとも20年間保存すること。
包装
1瓶[溶剤(日局 注射用水 10mL)添付]
〔注〕下記付属品を組み入れてあります。
溶解液注入針、翼状針、注射筒、フィルトラン、絆創膏、ポリ袋、アルコール綿
主要文献
1
福井 弘 他:基礎と臨床 1992;26(7):3341-3355
2
福井 弘 他:基礎と臨床 1993;27(1):277-290
3
日本血液製剤機構:内部資料(第VIII因子欠乏血漿及びフォンウィルブランド因子欠乏血漿に対するGA-0876の補正効果の検討)
文献請求先及び問い合わせ先
製造販売業者等
一般社団法人 日本血液製剤機構
東京都港区芝浦3-1-1
この製品は献血血液から製造されています。
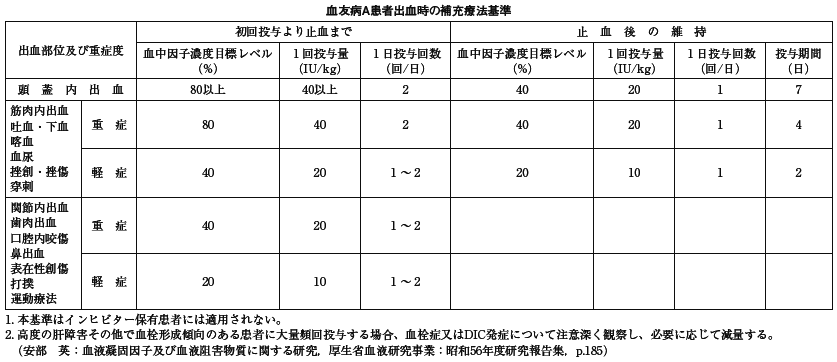
〔参考:血友病Aに対する投与量の基準〕
本剤の投与量は、出血部位と症状、因子欠乏の程度、患者の体重、抑制因子(インヒビター)の有無とその量、更に期待される凝固因子レベルなどによって決定される。
通常体重1kg当たり第VIII因子を1国際単位投与したとき、血中第VIII因子レベルは2%上昇するとされている。本剤投与時の第VIII因子活性の上昇期待値は次式を用いて求められる。
また、投与に必要な第VIII因子力価は
上式はインヒビターが存在しない場合であるので、インヒビターが存在する場合は、次式を用いてインヒビターが中和される量をプラスして投与しなければならない。
第VIII因子1国際単位に結合するインヒビターは約2単位といわれている。
コンコエイト-HTの溶解法及び溶解液注入針の使い方
①添付の溶剤瓶を室温程度にまで温めてください。
決して37℃を超えて加温しないでください。
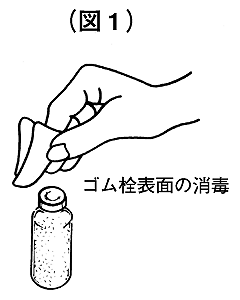
②コンコエイト-HTと溶剤の両方の瓶のキャップを除去しゴム栓の表面を消毒してください(図1)。
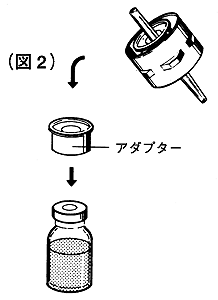
③溶解液注入針に添付のアダプターを溶剤瓶にセットします(図2)。
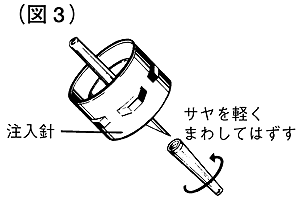
④溶解液注入針の保護サヤをまず片方だけ軽くまわしてはずします(図3)。
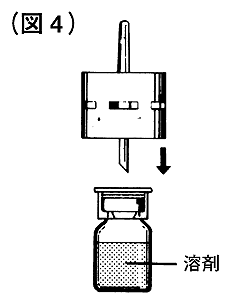
⑤溶解液注入針を溶剤瓶のゴム栓中央に真っすぐ深く刺入してください(図4)。
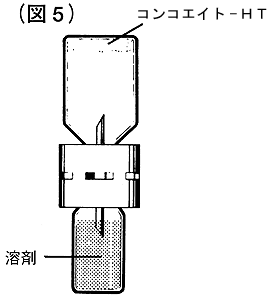
⑥溶解液注入針の反対側の保護サヤを軽くまわしてはずし、コンコエイト-HT瓶を倒立させて溶解液注入針をゴム栓の中央大きい○印の箇所に真っすぐ深く刺入してください(図5)。
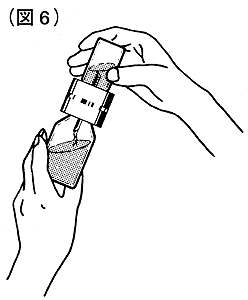
⑦溶剤瓶が上になるように逆転してください。液が流れ始めたら連結された両方の瓶を斜めにして液ができるだけコンコエイト-HT瓶の壁面に沿って流れ込むようにしてください(図6)。
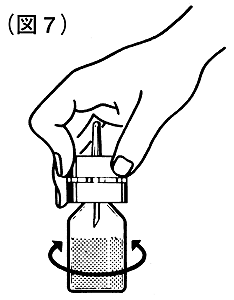
⑧溶剤瓶をはずし、溶解液注入針に保護サヤをはめます。
その状態でコンコエイト-HT瓶をゆるく振盪し、完全に溶解させてください(図7)。
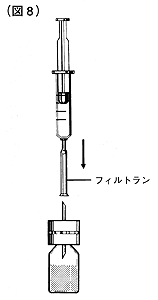
⑨溶解液注入針の保護サヤをはずし、フィルトランを注射筒にセットします。
フィルトラン付注射筒をコンコエイト-HTの容量分引き、そのまま溶解液注入針の針部に深く刺し込み、押し子を押し込んでください(図8)。
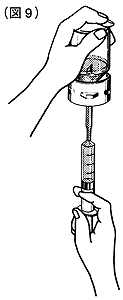
⑩コンコエイト-HT瓶を倒立させ、注射筒にコンコエイト-HTを取り出してください(図9)。
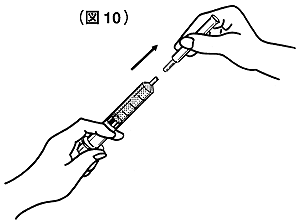
⑪注射筒からフィルトランを抜き取ってください(図10)。
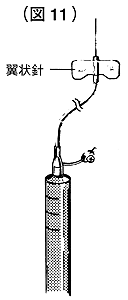
⑫翼状針を装着して静脈内に投与してください(図11)。