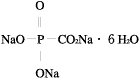1
Taburet, A.M., et al.:Antimicrob. Agents Chemother., 1992, 36(9) 1821-1824
2
Castelli, F., et al.:Eur. J. Clin. Pharmacol., 1997, 52, 397-401
3
Sjövall, J., et al.:Clin. Pharmacol. Ther., 1988, 44(1) 65-73
4
Raffi, F., et al.:Antimicrob. Agents Chemother., 1993, 37(9) 1777-1780
5
Sjövall, J., et al.:Antimicrob. Agents Chemother., 1989, 37(9) 1023-1031
6
Aweeka, F.T., et al.:J. Acquir. Immune Defic. Syndr. Hum. Retrovirol., 1999, 20(4) 350-357
7
Aweeka, F.T., et al.:Antimicrob. Agents Chemother., 1992, 36(8) 1773-1778
8
Aweeka, F.T., et al.:Clin. Pharmacol. Ther., 1995, 57(4) 403-412
9
木村 哲 他:化学療法の領域, 2002, 18(10) 77-90
10
Derse, D., et al.:J. Biol. Chem., 1982, 257(17) 10251-10260
11
Wahren, B., et al.:Intervirology, 1980, 14, 7-15
12
Kern, E.R., et al.:Antimicrob. Agents Chemother., 1978, 14(6) 817-823
13
Akesson-Johansson A., et al.:Antimicrob. Agents Chemother., 1990, 34(12) 2417-2419
14
Drew, W.L., et al.:Abstract Th. B. 306 Presented at the XI International Congress on AIDS, 1996, Vancouver, Canada July 7-12