1
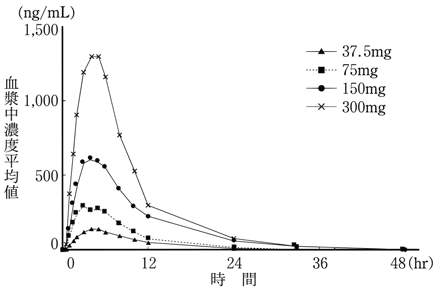
健康成人における単回投与試験(国内:JP15734)(2000年12月12日承認、申請資料概要ヘ.3-1)
2
日本人と白人での反復投与試験(薬物動態直接比較試験)(海外:JP15735)(2000年12月12日承認、申請資料概要ヘ.3-5)
3
臓器、組織内濃度(2000年12月12日承認、申請資料概要ヘ.2-2-1)
4
血漿蛋白質との結合(2000年12月12日承認、申請資料概要ヘ.2-2-4)
5
in vitro代謝(2000年12月12日承認、申請資料概要ヘ.2-3-2)
6
乳汁中への移行(2000年12月12日承認、申請資料概要ヘ.2-4-3)
7
Abe M, et al. Ann Pharmacother. 2006;40:1724-30.
8
腎機能障害を伴う被験者による反復投与試験(海外:WP15648)(2000年12月12日承認、申請資料概要ヘ.3-7-1)
9
in vitro薬物相互作用(2000年12月12日承認、申請資料概要ヘ.2-3-5)
10
腎排泄型薬剤(シメチジン/プロベネシド)との薬物相互作用(海外:WP15728)(2000年12月12日承認、申請資料概要ヘ.3-8-2)
11
柏木征三郎, 他. 感染症学雑誌. 2000;74:1044-61.
12
第Ⅲ相治療試験の有効性のまとめ(海外:WV15670/15671/15730)(2000年12月12日承認、申請資料概要ト.1-3-2)
13
柏木征三郎, 他. 感染症学雑誌. 2000;74:1062-76.
14
成人に対する第Ⅲ相予防試験(42日間投与)(海外:WV15673/15697)(2004年7月9日承認、申請資料概要ト.1-3-2)
15
高齢者に対する第Ⅲ相予防試験(42日間投与)(海外:WV15825)(2004年7月9日承認、申請資料概要ト.1-3-2)
16
第Ⅲ相予防試験(7日間投与)(海外:WV15799)(2004年7月9日承認、申請資料概要ト.1-3-2)
17
第Ⅲ相予防試験(10日間投与)(海外:WV16193)(2004年7月9日承認、申請資料概要ト.1-3-2)
18
社内資料:ノイラミニダーゼ阻害作用
19
社内資料:ヒトインフルエンザA型及びB型ウイルスにおけるin vitro増殖抑制作用
20
Sidwell RW, et al. Antiviral Res. 1998;37:107-20.
21
Mendel DB, et al. Antimicrob Agents Chemother. 1998;42:640-6.
22
社内資料:動物モデルにおける効果:ニワトリ感染モデル