| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
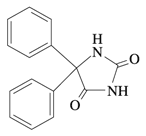
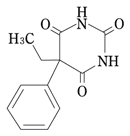
ゾニサミド
トピラマート
クロラムフェニコール
タクロリムス
テラプレビル | (1)フェニトインの血中濃度が上昇することがある注1)。
(2)これらの薬剤の血中濃度が低下することがある注2)。 | (1)これらの薬剤が肝代謝を抑制すると考えられている。タクロリムス、テラプレビルの機序は不明である。
(2)本剤の肝薬物代謝酵素誘導作用によると考えられている。 |
ルフィナミド | (1)フェニトインの血中濃度が上昇することがある注1)。
(2)これらの薬剤の血中濃度が低下することがある注2)。 | (1)、(2)機序不明 |
クロバザム | (1)フェニトイン、フェノバルビタールの血中濃度が上昇することがある注1)。
(2)これらの薬剤の血中濃度が低下することがある注2)。 | (1)機序不明
(2)本剤の肝薬物代謝酵素誘導作用による。 |
スチリペントール | (1)フェニトイン、フェノバルビタールの血中濃度が上昇することがある注1)。
(2)これらの薬剤の血中濃度が低下することがある注2)。 | (1)スチリペントールが肝代謝を抑制する。
(2)本剤の肝薬物代謝酵素誘導作用による。 |
カルバマゼピン | (1)フェニトインの血中濃度が上昇することがある注1)。
(2)フェニトインの血中濃度が低下することがある注3)。
(3)これらの薬剤の血中濃度が低下することがある注2)。 | (1)カルバマゼピンが肝代謝を抑制する。
(2)カルバマゼピンの肝薬物代謝酵素誘導作用による。
(3)本剤の肝薬物代謝酵素誘導作用による。 |
ネルフィナビル | (1)フェニトインの血中濃度が上昇することがある注1)。
(2)フェニトインの血中濃度が低下することがある注3)。
(3)これらの薬剤の血中濃度が低下することがある注2)。 | (1)ネルフィナビルが肝代謝を抑制すると考えられている。
(2)機序不明
(3)機序は不明であるが、本剤の肝薬物代謝酵素誘導作用等が考えられている。 |
バルプロ酸 | (1)フェニトイン、フェノバルビタールの血中濃度が上昇することがある注1)。
(2)フェニトインの血中濃度が低下することがある注3)。
(3)バルプロ酸の血中濃度が低下することがある注2)。 (4)バルプロ酸による高アンモニア血症の発現リスクが高まるおそれがある 。 | (1)バルプロ酸が肝代謝を抑制する。
(2)バルプロ酸による蛋白結合からの置換により、遊離フェニトイン濃度が上昇し、肝代謝が促進すると考えられている。
(3)本剤の肝薬物代謝酵素誘導作用による。 (4)機序不明 |
中枢神経抑制剤 フェノチアジン誘導体、バルビツール酸誘導体、トランキライザー等 抗ヒスタミン剤 ジフェンヒドラミン等 アルコール | 相互に作用が増強されることがあるので、減量するなど注意すること。 | フェノバルビタールとの相加的中枢神経抑制作用による。 |
MAO阻害剤 | 相互に作用が増強されることがあるので、減量するなど注意すること。 | 機序不明 |
三環系抗うつ剤 イミプラミン等 四環系抗うつ剤 マプロチリン等 トラゾドン | (1)相互に作用が増強されることがあるので、減量するなど注意すること。
(2)フェニトインの血中濃度が上昇することがある注1)。
(3)これらの薬剤の血中濃度が低下することがある注2)。 | (1)フェノバルビタールとの相加的中枢神経抑制作用による。
(2)機序不明
(3)本剤の肝薬物代謝酵素誘導作用による。 |
クマリン系抗凝血剤 ワルファリン | (1)フェニトインの血中濃度が上昇することがある注1)。
(2)クマリン系抗凝血剤の作用が増強することがある。
(3)クマリン系抗凝血剤の作用が減弱することがある。
通常より頻回に血液凝固時間の測定を行い、クマリン系抗凝血剤の用量を調整すること。 | (1)クマリン系抗凝血剤が肝代謝を抑制する。
(2)フェニトインによる蛋白結合からの置換により、クマリン系抗凝血剤の血中濃度が上昇する。
(3)本剤の肝薬物代謝酵素誘導作用による。 |
メチルフェニデート | フェニトイン、フェノバルビタールの血中濃度が上昇することがある注1)。 | メチルフェニデートが肝代謝を抑制するためと考えられている。 |
CYP2C9又はCYP2C19を阻害する薬剤 アミオダロン シメチジン スルファメトキサゾール・トリメトプリム チクロピジン フルコナゾール フルボキサミン ホスフルコナゾール ミコナゾール セリチニブ アシミニブ ニチシノン | フェニトインの血中濃度が上昇することがある注1) 。 | これらの薬剤又は代謝物が肝代謝を抑制すると考えられている。 |
アロプリノール
イソニアジド
エトスクシミド
オメプラゾール
ジスルフィラム
ジルチアゼム
スルチアム
パラアミノサリチル酸
エソメプラゾール | フェニトインの血中濃度が上昇することがある注1)。 | これらの薬剤又は代謝物が肝代謝を抑制すると考えられている。 |
フルオロウラシル系薬剤 テガフール製剤、ドキシフルリジン等 | フェニトインの血中濃度が上昇することがある注1)。 | 機序不明 |
テオフィリン
アミノフィリン水和物 | (1)フェニトインの血中濃度が低下することがある注3)。
(2)テオフィリンの血中濃度が低下することがある注2)。 | (1)機序不明
(2)本剤の肝薬物代謝酵素誘導作用による。 |
リファンピシン
アパルタミド
レテルモビル | フェニトインの血中濃度が低下することがある注3)。 | これらの薬剤の肝薬物代謝酵素誘導作用による。 |
ジアゾキシド
シスプラチン
ビンカアルカロイド ビンクリスチン等 シプロフロキサシン
ビガバトリン | フェニトインの血中濃度が低下することがある注3)。 | 機序不明 |
イリノテカン | イリノテカンの活性代謝物の血中濃度が低下し、作用が減弱することがあるので、併用を避けることが望ましい。 | 本剤の肝薬物代謝酵素誘導作用による。 |
主にCYP3Aの基質となる薬剤 アゼルニジピン
イグラチモド
イトラコナゾール
イマチニブ
オンダンセトロン
キニジン
クエチアピン
ジソピラミド
ニソルジピン
ニフェジピン
フェロジピン
プラジカンテル
ベラパミル
モンテルカスト
等
副腎皮質ホルモン剤 デキサメタゾン等 卵胞ホルモン剤・黄体ホルモン剤 ノルゲストレル・エチニルエストラジオール等 PDE5阻害剤 タダラフィル(勃起不全、前立腺肥大症に伴う排尿障害を適応とする場合:シアリス、ザルティア)、シルデナフィル、バルデナフィル | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素誘導作用による。 |
パロキセチン
フレカイニド
メキシレチン | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素誘導作用による。 |
CYP3A及びP糖蛋白の基質となる薬剤 アピキサバン
ミラベグロン
レンバチニブ等 | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素誘導作用及びP糖蛋白誘導作用による。 |
P糖蛋白の基質となる薬剤 グレカプレビル・ピブレンタスビル
テノホビル アラフェナミド
ニンテダニブ等 | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤のP糖蛋白誘導作用による。 |
ラモトリギン
デフェラシロクス
カナグリフロジン
ラルテグラビル | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤がこれらの薬剤のグルクロン酸抱合を促進する。 |
ポサコナゾール | これらの薬剤の血中濃度が低下することがある注2)。 | フェニトインのUGT1A4誘導作用及び/又はP糖蛋白誘導作用による。 |
シクロスポリン | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素誘導作用、又はフェニトインの吸収阻害作用が考えられている。 |
甲状腺ホルモン剤 レボチロキシン等 | これらの薬剤の血中濃度が低下することがある注2)。 | 機序不明 |
カスポファンギン | これらの薬剤の血中濃度が低下することがある注2)。 | フェニトインがカスポファンギンの取り込み輸送過程に影響し、カスポファンギンのクリアランス誘導が起こると考えられている。 |
ドルテグラビル
ドルテグラビル・ラミブジン
ドルテグラビル・アバカビル・ラミブジン | ドルテグラビルの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A4)誘導作用及びUGT1A1誘導作用による。 |
アルベンダゾール | アルベンダゾールの活性代謝物の血中濃度が低下し、効果が減弱することがある。 | 機序不明 |
ドキシサイクリン | ドキシサイクリンの血中濃度半減期が短縮することがある。 | 本剤の肝薬物代謝酵素誘導作用による。 |
非脱分極性筋弛緩剤 ベクロニウム等 | フェニトインを長期前投与した場合、非脱分極性筋弛緩剤の作用が減弱することがある。 | 機序不明 |
血糖降下剤 インスリン、経口血糖降下剤 | 血糖降下剤の作用が減弱され、高血糖を起こすことがあるので、血糖の上昇に注意すること。 | フェニトインのインスリン分泌抑制作用による。 |
利尿剤 チアジド系降圧利尿剤等 | 起立性低血圧が増強されることがあるので、減量するなど注意すること。 | 機序は不明であるが、高用量のフェノバルビタールは血圧を低下させることがある。 |
アセタゾラミド
| くる病、骨軟化症があらわれやすい。 | 本剤によるビタミンDの不活性化促進、又はアセタゾラミドによる腎尿細管障害、代謝性アシドーシス等が考えられている。 |
アセトアミノフェン | 本剤の長期連用者は、アセトアミノフェンの代謝物による肝障害を生じやすくなる。 | 本剤の肝薬物代謝酵素誘導作用により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進されると考えられている。 |
セイヨウオトギリソウ(St.John’s Wort、セント・ジョーンズ・ワート)含有食品 | フェニトイン、フェノバルビタールの代謝が促進され血中濃度が低下するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | セイヨウオトギリソウの肝薬物代謝酵素誘導作用によると考えられている。 |