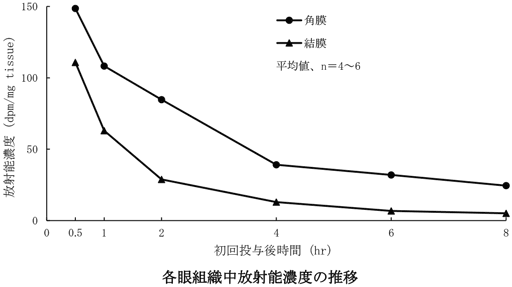
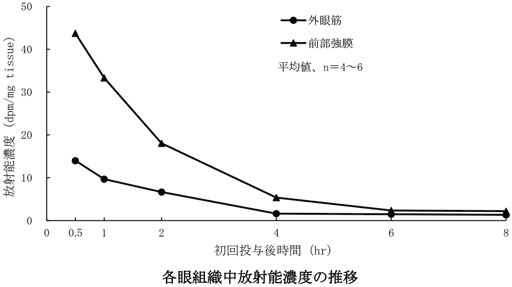
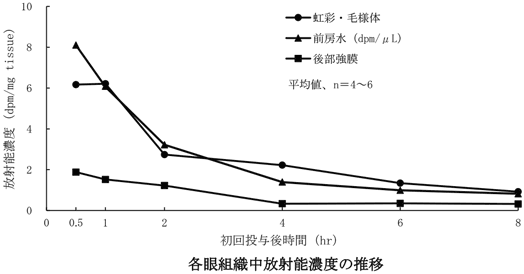
1
浜田佑二 他:医薬品研究. 1978;9:194-204
2
小河貴裕 他:日本眼科紀要. 1986;37:829-834
3
北野周作 他:眼科臨床医報. 1985;79:432-438
4
北野周作 他:眼科臨床医報. 1988;82:706-714
5
小河貴裕 他:あたらしい眼科. 1988;5:1335-1342
6
今吉朋憲 他:炎症. 1984;4(S-1):223-227
7
後藤一洋 他:薬学雑誌. 1977;97:1211-1215
8
中西美智夫 他:薬学雑誌. 1975;95:1027-1037
9
中西美智夫 他:薬学雑誌. 1975;95:672-679
10
後藤一洋 他:薬学雑誌. 1977;97:382-387
11
後藤一洋 他:薬学雑誌. 1976;96:1013-1021
12
小河貴裕 他:日本眼科紀要. 1982;33:1244-1251
13
社内資料:生物学的同等性試験