1
Flower RJ, et al.:Biochem Pharmacol. 1974; 23: 1439-50
2
Friedman CA, et al.:Dev Pharmacol Ther. 1991; 17: 1-7
3
板橋家頭夫, 他:周産期医学. 1992; 22(12): 1761-71
未熟児動脈管開存症治療剤
1瓶 6554円
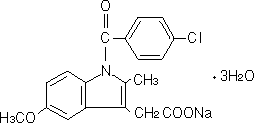
有効成分 | 1バイアル中 インドメタシンナトリウム水和物として 1.21mgインドメタシンとして 1mg |
|---|
| 外観・性状 | 微黄色〜黄色の粉末の凍結乾燥注射剤 |
|---|
| pH及び浸透圧比 | |
| 溶解液: 生理食塩液 | 単位/用量 1mg/1mL pH 6.0〜7.5 浸透圧比注) 約1 |
|---|---|
| 溶解液: 生理食塩液 | 単位/用量 1mg/2mL pH 6.0〜7.5 浸透圧比注) 約1 |
| 溶解液: 注射用水 | 単位/用量 1mg/1mL pH 6.0〜7.5 浸透圧比注) 約0.05 |
| 溶解液: 注射用水 | 単位/用量 1mg/2mL pH 6.0〜7.5 浸透圧比注) 約0.04 |
初回投与時の生後時間 | 投与量(mg/kg) | ||
1回目 | 2回目 | 3回目 | |
生後48時間未満 | 0.2 | 0.1 | 0.1 |
生後2〜7日未満 | 0.2 | 0.2 | 0.2 |
生後7日以上 | 0.2 | 0.25 | 0.25 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ループ利尿剤 フロセミド チアジド系利尿剤 ヒドロクロロチアジド | これらの医薬品の利尿降圧作用を減弱させるおそれがある。 | 本剤がプロスタグランジン合成を阻害して、水、塩類の体内貯留が生じ、利尿剤の水、塩類排泄作用に拮抗するためと考えられている。 |
ジギタリス | ジギタリスの作用を増強することがある。 | 本剤のプロスタグランジン合成阻害作用により腎血流量が減少し、ジギタリスの腎排泄が減少するためと考えられている。 |
アミノグリコシド系抗生物質 | アミノグリコシド系抗生物質の作用を増強することがある。 | 本剤のプロスタグランジン合成阻害作用により腎血流量が減少し、アミノグリコシド系抗生物質の腎排泄が減少するためと考えられている。 |
5%以上 | 0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|---|
消化器 | 腹部膨満、嘔吐 | |||
肝臓 | 肝機能異常(AST上昇、ALT上昇) | |||
腎臓 | 尿量減少、腎機能異常(BUN上昇、血清クレアチニン上昇等) | 血清カリウム上昇、低ナトリウム血症、蛋白尿 | 尿浸透圧の低下 | 尿中ナトリウム減少、尿中カリウム減少、尿中塩素減少、自由水クリアランス又は糸球体ろ過率の減少 |
血液 | 血小板減少、貧血、白血球減少 | 血小板凝集能低下 | ||
感染症 | 感染症の増悪 | |||
その他 | 黄疸、ビリルビン上昇、体重増加(体液貯留) | 針穿刺後の皮膚出血 |
出生後時間 | 血漿中濃度半減期 |
生後7日未満(n=18) | 約20時間(範囲:3〜60時間) |
生後7日以上(n=10) | 約12時間(範囲:4〜38時間) |
出生時体重 | 血漿中濃度半減期 |
1,000g未満(n=10) | 約21時間(範囲:9〜60時間) |
1,000g以上(n=18) | 約15時間(範囲:3〜52時間) |