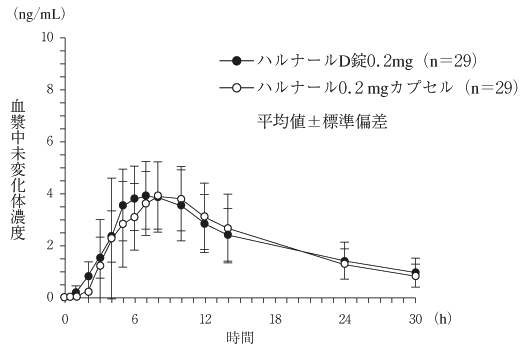
1
角尾道夫 他:臨床医薬 1990;6(12):2529-2551[HA-0011]
2
角尾道夫 他:臨床医薬 1991;7(1):63-83[HA-0012]
3
横山 修 他:薬理と治療 2005;33(6):521-526[HA-05486]
4
横山 修 他:薬理と治療 2005;33(6):535-540[HA-05485]
5
横山 修 他:薬理と治療 2005;33(6):527-533[HA-05483]
6
Koiso, K. et al.:J. Clin. Pharmacol. 1996;36(11):1029-1038[HA-00314]
7
Kawachi, Y.:Curr. Ther. Res. 1998;59(3):149-161[HA-04828]
8
河邉香月 他:泌尿器外科 1990;3(10):1247-1259[HA-0027]
9
Kawabe, K. et al.:J. Urol. 1990;144(4):908-912[HA-0038]
10
河邉香月 他:泌尿器外科 1991;4(2):231-242[HA-0026]
11
Yamada, S. et al.:J. Pharmacol. Exp. Ther. 1987;242(1):326-330[HA-0003]
12
Honda, K. et al.:Naunyn-Schmiedeberg’s Arch. Pharmacol. 1985;328(3):264-272[HA-0036]
13
Honda, K. et al.:Naunyn-Schmiedeberg’s Arch. Pharmacol. 1987;336(3):295-302[HA-0035]
14
Honda, K. et al.:J. Pharmacol. Exp. Ther. 1986;239(2):512-516[HA-0006]
15
Honda, K. et al.:Naunyn-Schmiedeberg’s Arch. Pharmacol. 1985;330(1):16-21[HA-0004]
16
Shibasaki, M. et al.:J. Auton. Pharmacol. 1992;12(4):263-268[HA-0037]
17
Sudoh, K. et al.:J. Auton. Pharmacol. 1996;16(3):147-154[HA-00242]
18
Sudoh, K. et al.:Gen. Pharmacol. 1997;28(4):521-524[HA-07004]






 HA0.1
HA0.1

 HA0.2
HA0.2