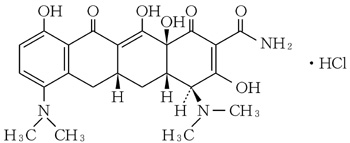
テトラサイクリン系抗生物質製剤
1錠 11.2円
| 剤形 | 直径(mm) | 重量(mg) | 厚さ(mm) | 性状 | 本体表示 | 外形 |
| フィルムコーティング錠 | 6.1 | 約91 | 3.5 | 黄色〜暗黄色 | MINO 50 |  |
| 剤形 | 直径(mm) | 重量(mg) | 厚さ(mm) | 性状 | 本体表示 | 外形 |
| フィルムコーティング錠 | 8.1 | 約181 | 4.1 | 黄色〜暗黄色 | MINO 100 |  |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| カルシウム、マグネシウム、アルミニウム、ランタン又は鉄剤 | 本剤の吸収が低下し、効果が減弱されるおそれがある。 両剤の服用間隔を2〜4時間とすること。 | 本剤と二価又は三価の金属イオンが消化管内で難溶性のキレートを形成して、本剤の吸収を阻害する。 |
| 抗凝血剤 ワルファリンカリウム等 | 血漿プロトロンビン活性を抑制することがある。 | 本剤による腸内細菌の減少が、ビタミンK合成を阻害し、抗凝血剤の作用を増強するほか、本剤がカルシウムイオンとキレート結合し、血漿プロトロンビン活性を抑制すると考えられている。 |
| スルホニル尿素系血糖降下薬 | 血糖降下作用が増強することがある。 | 機序は不明であるが、スルホニル尿素系薬剤の血糖降下作用がオキシテトラサイクリン及びドキシサイクリンによって増強されるという報告がある。 |
| メトトレキサート | メトトレキサートの作用が増強されることがある。 | 本剤は血漿蛋白と結合しているメトトレキサートを競合的に置換遊離し、メトトレキサートの作用を増強させることが考えられる。 |
| ポルフィマーナトリウム | 光線過敏症を起こすおそれがある。 直射日光、集中光等を避けること。 | 皮膚の光感受性を高める薬剤との併用により、本剤による光線過敏症が増強されることが考えられる。 |
| ジゴキシン | 本剤がジゴキシンの作用を増強し、中毒症状が発現することがある。 併用時はジゴキシンの中毒症状に注意すること。 | 本剤による腸内細菌の減少のため、腸内細菌によるジゴキシンの代謝が不活性化され、ジゴキシンの血中濃度が上昇すると考えられる。 |
| 黄体・卵胞ホルモン配合剤 経口避妊剤 | 黄体・卵胞ホルモン配合剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | 本剤による腸内細菌の減少のため、黄体・卵胞ホルモン配合剤の腸肝循環による再吸収が抑制されると考えられる。 |
| 外用剤を除くビタミンA製剤、レチノイド製剤 ビタミンA レチノールパルミチン酸エステル エトレチナート トレチノイン | 頭蓋内圧上昇があらわれることがある。 | 本剤及びこれらの薬剤はそれぞれ頭蓋内圧上昇を起こすことがある。 |
| 頻度不明 | |
| 過敏症注1) | 発疹、発熱、浮腫(四肢、顔面)、蕁麻疹 |
| 皮膚 | 色素沈着(皮膚・爪・粘膜)注2)、光線過敏症注3)、急性熱性好中球性皮膚症 |
| 精神神経系 | めまい感、頭痛、しびれ感 |
| 肝臓 | AST(GOT)、ALT(GPT)の上昇等肝機能検査値異常、黄疸 |
| 消化器 | 腹痛、悪心、食欲不振、胃腸障害、嘔吐、下痢、舌炎、便秘、口内炎、味覚異常、肛門周囲炎、歯牙着色、舌変色 |
| 血液 | 好酸球増多 |
| 腎臓 | BUN上昇 |
| 菌交代症注3) | 菌交代症に基づく新しい感染症 |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) |
| 頭蓋内圧上昇注1) | 頭蓋内圧上昇に伴う症状(嘔吐、頭痛、複視、うっ血乳頭、大泉門膨隆等) |
| 感覚器 | 耳鳴、聴覚障害 |
| その他 | 倦怠感、関節痛 |
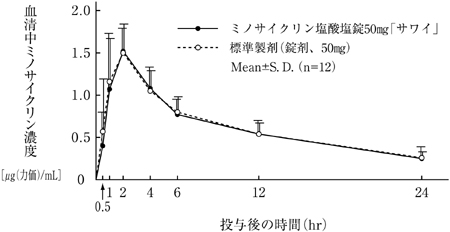
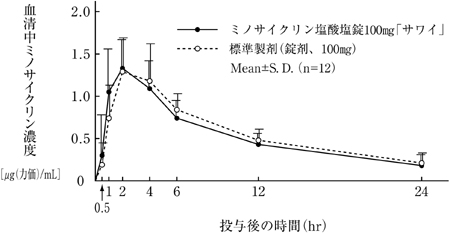
| Cmax[μg(力価)/mL] | Tmax(hr) | T1/2(hr) | AUC0-24hr[μg(力価)・hr/mL] | |
| ミノサイクリン塩酸塩錠50mg「サワイ」 | 1.59±0.31 | 1.7±0.5 | 11.7±2.9 | 14.93±3.59 |
| 標準製剤(錠剤、50mg) | 1.61±0.35 | 1.6±0.6 | 11.2±1.4 | 15.12±2.82 |
| Cmax[μg(力価)/mL] | Tmax(hr) | T1/2(hr) | AUC0-24hr[μg(力価)・hr/mL] | |
| ミノサイクリン塩酸塩錠100mg「サワイ」 | 1.44±0.36 | 1.8±0.8 | 9.2±2.9 | 12.97±3.37 |
| 標準製剤(錠剤、100mg) | 1.47±0.43 | 2.3±0.9 | 9.6±1.6 | 13.91±3.33 |