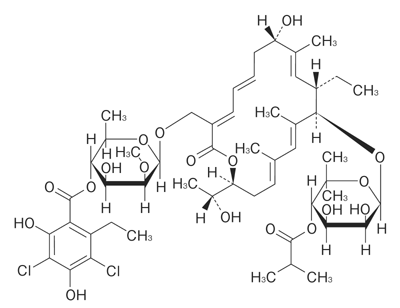
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き[R-07700]
2
Oshima, H. et al.:Clin. Drug Investig. 2015;35(6):375-384 [DAF-00009]
3
社内報告書:クロストリジウム・ディフィシルによる腸炎患者・国内第Ⅲ相試験(2018年7月2日承認 CTD2.7.2.2.2.10)[DIR180010]
4
社内報告書:溶解度及び膜透過性・薬物動態(2018年7月2日承認 CTD2.7.2.2.1.15)[DIR180012]
5
社内報告書:P-gp基質性及び阻害作用・薬物動態(2018年7月2日承認 CTD2.7.2.2.1.7、CTD2.7.2.2.1.8)[DIR180013]
6
社内報告書:イヌ絶対バイオアベイラビリティ・薬物動態(2018年7月2日承認 CTD2.6.4.3.2.2)[DIR180014]
7
社内報告書:海外健康成人・食事の影響試験(2018年7月2日承認 CTD2.7.1.2.2、CTD2.7.2.2.2.4)[DIR180011]
8
社内報告書:血漿蛋白結合率・薬物動態(2018年7月2日承認 CTD2.7.2.2.1.1)[DIR180015]
9
社内報告書:代謝・薬物動態(2018年7月2日承認 CTD2.7.2.3.1.6)[DIR180141]
10
社内報告書:クロストリジウム・ディフィシルによる腸炎患者・国内第Ⅲ相試験・薬物動態層別解析(2018年7月2日承認 CTD2.7.2.3.3.1、2.7.2.3.3.4)[DIR180023]
11
社内報告書:海外健康成人・薬物相互作用試験(シクロスポリン)(2018年7月2日承認 CTD2.7.2.2.2.5)[DIR180019]
12
社内報告書:海外健康成人・薬物相互作用試験(ワルファリン、オメプラゾール、ミダゾラム)(2018年7月2日承認 CTD2.7.2.2.2.7)[DIR180020]
13
社内報告書:海外健康成人・薬物相互作用試験(ジゴキシン)(2018年7月2日承認 CTD2.7.2.2.2.6)[DIR180021]
14
社内報告書:海外健康成人・薬物相互作用試験(ロスバスタチン)(2018年7月2日承認 CTD2.7.2.2.2.8)[DIR180022]
15
社内報告書:CYP阻害作用・薬物動態(2018年7月2日承認 CTD2.7.2.2.1.5)[DIR180016]
16
社内報告書:BCRP及びMRP2に対する基質性及び阻害作用・薬物動態(2018年7月2日承認 CTD2.7.2.2.1.9~CTD2.7.2.2.1.12)[DIR180017]
17
社内報告書:OATP2B1基質性及び阻害作用・薬物動態(2018年7月2日承認 CTD2.7.2.2.1.13、CTD2.7.2.2.1.14)[DIR180018]
18
社内報告書:クロストリジウム・ディフィシルによる腸炎患者・国内第Ⅲ相試験(2018年7月2日承認 CTD2.7.3.2.4)[DIR180024]
19
社内報告書:クロストリジウム・ディフィシルによる腸炎患者・海外第Ⅲ相試験(2018年7月2日承認 CTD2.7.3.2.2)[DIR180025]
20
社内報告書:クロストリジウム・ディフィシルによる腸炎患者・海外第Ⅲ相試験(2018年7月2日承認 CTD2.7.6.10)[DIR180044]
21
社内報告書:クロストリジウム・ディフィシルによる腸炎患者・海外第Ⅲ相試験(2018年7月2日承認 CTD2.7.3.2.3)[DIR180026]
22
社内報告書:クロストリジウム・ディフィシルによる腸炎患者・海外第Ⅲ相試験(2018年7月2日承認 CTD2.7.6.11)[DIR180045]
23
社内報告書:C. difficile由来RNAポリメラーゼに対する作用・薬理試験(2018年7月2日承認 CTD2.6.2.2.5)[DIR180029]
24
社内報告書:各種細菌に対する抗菌活性・薬理試験(2018年7月2日承認 CTD2.6.2.2.1)[DIR180027]





 320
320