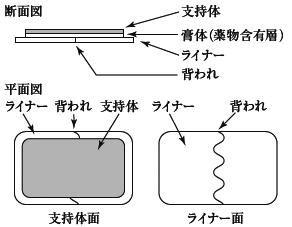
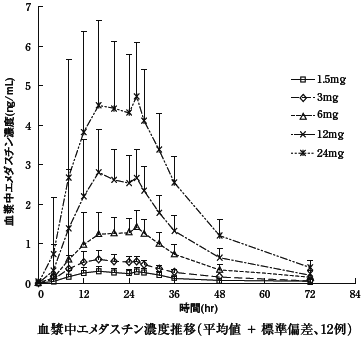
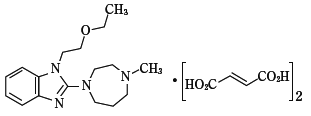
1
久光製薬社内資料. 第I相単回投与試験(2018年1月19日承認、CTD2.7.2.2.2.1).
2
久光製薬社内資料. 第I/II相反復投与試験(2018年1月19日承認、CTD2.7.2.2.2.2).
3
久光製薬社内資料. 第I相投与部位検討試験(2018年1月19日承認、CTD2.7.2.2.2.1).
4
久光製薬社内資料. ラット単回投与試験(2018年1月19日承認、CTD2.6.4.4.1).
5
久光製薬社内資料. ラット反復投与試験(2018年1月19日承認、CTD2.6.4.4.1).
6
Sakai T, et al.: 薬物動態 1987; 2(2): 147-54.
7
久光製薬社内資料. in vitro代謝試験(2018年1月19日承認、CTD2.6.4.5.3).
8
石田光裕 ほか: 基礎と臨床 1997; 31(10): 3089-93.
9
久光製薬社内資料. 第III相比較試験(2018年1月19日承認、CTD2.7.3.2.2).
10
久光製薬社内資料. 第III相長期投与試験(2018年1月19日承認、CTD2.7.3.2.3).
11
久光製薬社内資料. ラットヒスタミン誘発血管透過性亢進モデルを用いた薬効評価(2018年1月19日承認、CTD2.6.2.2).
12
Fukuda T, et al.: Arzneimittelforschung 1984; 34(7): 801-5.
13
Nishimura N, et al.: Immunopharmacol Immunotoxicol 1987; 9(4): 511-21.
14
Saito T, et al.: Jpn J Pharmacol 1993; 62(2): 137-43.
15
斉藤忠之 ほか: 西日本皮膚科 1993; 55(6): 1081-5.
16
Sharif NA, et al.: J Ocul Pharmacol 1994; 10(4): 653-64.