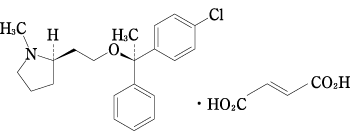
持続性抗ヒスタミン剤
1g 7.4円
| 性状 | 白色の片面割線入りの素錠 |
|---|---|
| *外形 | 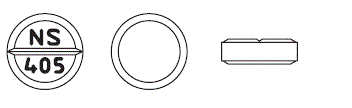 |
| *識別コード | NS405 |
| *大きさ(約) | 直径:7.0mm 厚さ:2.3mm 質量:0.12g |
| 性状 | ほとんど白色の微細な粒を含む粉末。わずかに甘味を有する。 |
|---|
| 性状 | 白色の微細な粒を含む粉末。わずかに苦味を有する。 |
|---|
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 中枢神経抑制剤(鎮静剤、催眠剤等) アルコール | 中枢神経抑制作用が増強されることがあるので、減量するなど慎重に投与すること。 | いずれも中枢神経抑制作用を有するため。 |
| 抗コリン剤(アトロピン等) MAO阻害剤 | 抗コリン作用が増強されることがあるので、減量するなど慎重に投与すること。 | 作用を増強させるため。 |