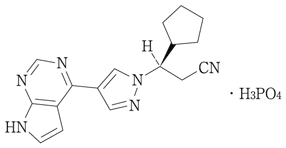
1
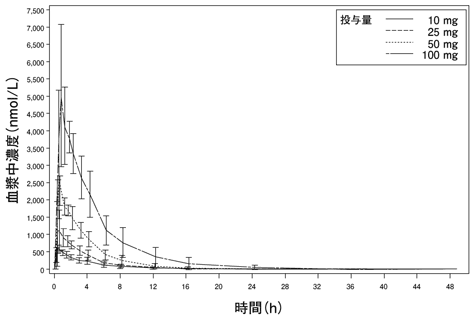
社内資料:国内第Ⅰ相臨床試験(1101試験)(2014年7月4日承認、CTD2.7.2-2.2.1)[20142625]
2
社内資料:国内第Ⅰ相臨床試験(1102試験)(2014年7月4日承認、CTD2.7.2-2.2.2)[20142624]
3
社内資料:蛋白結合率(2014年7月4日承認、CTD2.7.2-2.1.1)[20142634]
4
社内資料:CYP代謝酵素の同定(2014年7月4日承認、CTD2.7.2-2.1.2)[20142639]
5
Shilling,A.D.et al.:Drug Metab.Dispos. 2010; 38(11),2023-2031[20142299]
6
社内資料:腎機能障害患者を対象とした試験(142試験)(2014年7月4日承認、CTD2.7.2-2.4.2)[20142631]
7
社内資料:肝機能障害患者を対象とした試験(137試験)(2014年7月4日承認、CTD2.7.2-2.4.1)[20142632]
8
Shi.J.G., Chen.X., Emm.T.et al.: J. Clin. Pharmacol. 2012; 52(6),809-818[20142301]
9
社内資料:膜透過性,薬物トランスポーター阻害及び腸でのCYP3A4,Pgp,BCRP阻害(2014年7月4日承認、CTD2.7.2-2.1.3)[20142641]
10
社内資料:ミダゾラムとの薬物相互作用(2103試験)(2015年9月24日承認、CTD2.7.2-2.2)[20151293]
11
社内資料:経口避妊薬(エチニルエストラジオール及びレボノルゲストレル)との薬物相互作用(2102試験)(2015年9月24日承認、CTD2.7.2-2.1)[20151292]
12
Mesa,R.A.:Blood 2009; 113(22),5394-5400[20142280]
13
社内資料:骨髄線維症患者を対象としたアジア国際共同第Ⅱ相臨床試験(2202試験)(2014年7月4日承認、CTD2.7.6-4.2.1)[20142622]
14
社内資料:骨髄線維症患者を対象とした海外第Ⅲ相臨床試験(351試験)(2014年7月4日承認、CTD2.7.6-4.1.1)[20142620]
15
社内資料:骨髄線維症患者を対象とした海外第Ⅲ相臨床試験(2352試験)(2014年7月4日承認、CTD2.7.6-4.1.2)[20142621]
16
Tefferi,A.and Vardiman,J.W.:Leukemia 2008; 22(1),14-22[20142281]
17
Barosi,G.et al.:Leukemia 2008; 22(2),437-438[20142282]
18
Cervantes,F.et al.:Blood 2009; 113(13),2895-2901[20142283]
19
社内資料:真性多血症患者を対象とした国際共同第Ⅲ相臨床試験(2301試験)(2015年9月24日承認、CTD2.7.6-4.1.1)[20151295]
20
Barosi,G.et al.:Br.J.Haematol. 2010; 148(6),961-963[20155488]
21
社内資料:急性移植片対宿主病を対象とした国際共同第Ⅲ相臨床試験(C2301試験)(2023年8月23日承認、CTD2.7.6-4.1.1)[20220004]
22
Harris AC, Young R, Devine S, et al.: Biol Blood Marrow Transplant 2016 ; 22(1):4-10[20220362]
23
社内資料:慢性移植片対宿主病を対象とした国際共同第Ⅲ相臨床試験(D2301試験)(2023年8月23日承認、CTD2.7.6-4.1.2)[20220005]
24
Lee SJ, Wolff D, Kitko C, et al.: Biol Blood Marrow Transplant 2015; 21(6):984-999[20210063]
25
社内資料:In vitro酵素阻害作用(2014年7月4日承認、CTD2.6.2-2.1)[20142613]
26
社内資料:In vitro腫瘍増殖抑制作用(2014年7月4日承認、CTD2.6.2-2.2)[20142614]
27
社内資料:In vivo腫瘍増殖抑制作用(2014年7月4日承認、CTD2.6.2-2.3)[20142618]
28
社内資料:In vivoサイトカイン産生抑制作用(2014年7月4日承認、CTD2.6.2-2.3)[20142616]
29
社内資料:In vivo(変異型JAK)腫瘍増殖抑制作用(2015年9月24日承認、CTD2.6.2-2.2.1)[20151290]
30
社内資料:In vivo急性GVHD抑制作用(2023年8月23日承認、CTD2.6.2-2.1)[20220001]
31
社内資料:In vivo慢性GVHD抑制作用(2023年8月23日承認、CTD2.6.2-2.2)[20220002]