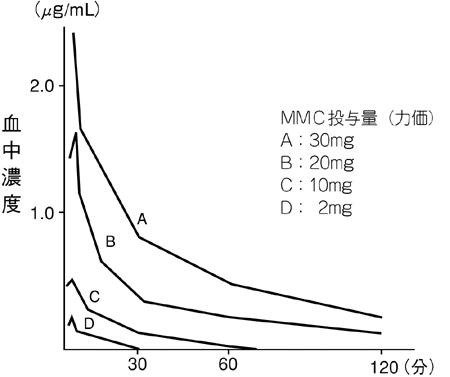
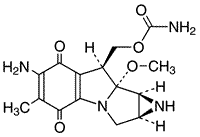
1
藤田浩:癌と化学療法. 1982;9:1362-1373
2
van Hazel GA, et al.:Cancer Treat Rep. 1983;67:805-810
3
Szybalski W, et al.:Fed Proc. 1964;23:946-957
4
藤田浩ほか:癌の臨床. 1966;S1;80-85
5
武正勇造ほか:診断と治療. 1969;57:1832-1840
6
坂部孝ほか:日大医誌. 1970;29:352-366
7
古江尚ほか:癌の臨床. 1970;16:896-909
8
Iyer VN, et al.:Proc Natl Acad Sci. 1963;50:355-362
9
Ohara H, et al.:GANN. 1972;63:317-327
10
Sugiura K.:Cancer Res. 1959;19:438-445
11
Kanamori H, et al.:J Antibiot. 1957;10:120-127