1
Manzoni P, et al.:N Engl J Med. 2005; 353: 2190-2191[000944]
2
Besarab A, et al.:N Engl J Med. 1998; 339: 584-590[65152]
3
Singh AK, et al.:N Engl J Med. 2006; 355: 2085-2098[65153]
4
Pfeffer MA, et al.:N Engl J Med. 2009; 361: 2019-2032[65155]
5
Leyland-Jones B, et al.:J Clin Oncol. 2005; 23: 5960-5972[66386]
6
Henke M, et al.:Lancet. 2003; 362: 1255-1260[65283]
7
Overgaard J, et al.:J Clin Oncol. 2009; 27: 302s[66387]
8
Luksenburg H, et al.:FDA Briefing Document. ODAC May 4, 2004[65284]
9
Smith RE Jr, et al.:J Clin Oncol. 2008; 26: 1040-1050[66388]
10
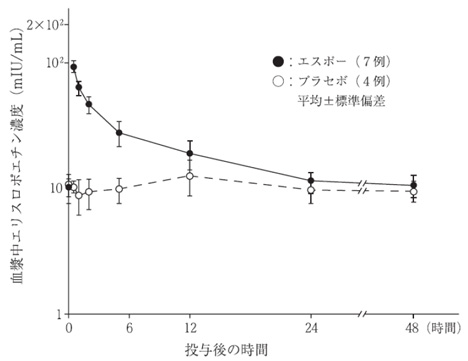
社内資料:健康成人を対象とした第Ⅰ相臨床試験[66271]
11
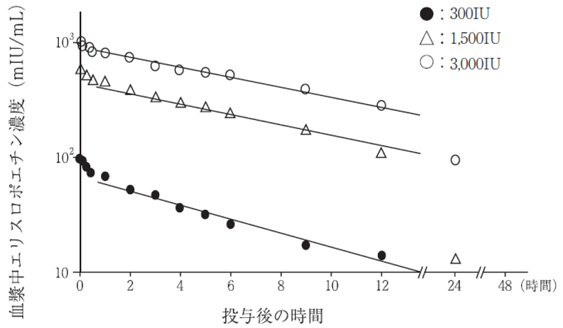
社内資料:血液透析施行中の腎性貧血患者を対象とした臨床薬理試験[66272]
12
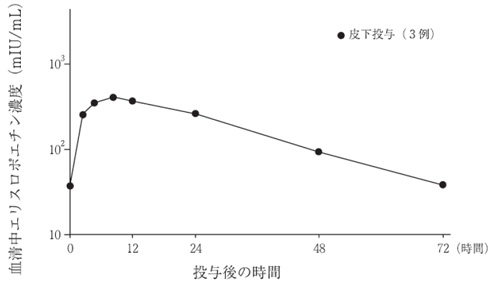
社内資料:健康成人を対象とした臨床薬理試験[66273]
13
田中孝司ほか:臨床評価. 1988; 16: 547-563[000945]
14
小出桂三ほか:臨床薬理. 1989; 20: 391-397[000946]
15
中村友彦ほか:日本産婦人科・新生児血液学会誌. 1993; 3: 39-42[000947]
16
植村家顯ほか:基礎と臨床. 1988; 22: 5583-5602[000948]
17
美細津正ほか:薬物動態. 1993; 8: 1065-1083[000949]
18
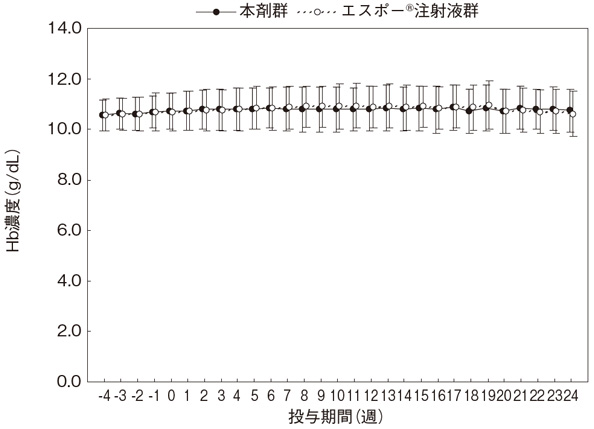
秋葉隆ほか:薬理と治療. 2010; 38: 181-198[65596]
19
秋葉隆ほか:薬理と治療. 2010; 38: 199-212[65597]
20
高久史麿ほか:腎と透析. 1988; 24: 1009-1025[000950]
21
前田貞亮ほか:腎と透析. 1989; 26: 1115-1136[000951]
22
川口良人ほか:臨床医薬. 1988; 4: 2075-2100[000952]
23
久保和雄ほか:臨床透析. 1989; 5: 603-619[000953]
24
高久史麿ほか:腎と透析. 1989; 26: 279-306[000954]
25
藤見惺ほか:医学のあゆみ. 1989; 148: 759-773[000955]
26
中畑龍俊ほか:小児内科. 1993; 25: 595-610[65107]
27
多田裕ほか:周産期医学. 1996; 26: 1031-1038[65109]
28
多田裕ほか:周産期医学. 1993; 23: 917-929[65108]
29
社内資料:ヒトエリスロポエチン受容体に対する結合親和性[66274]
30
社内資料:ヒトエリスロポエチン依存性細胞における増殖作用[66275]
31
社内資料:ヒト骨髄赤芽球系前駆細胞の分化・増殖促進作用[66276]
32
社内資料:正常ラットにおける単回静脈内及び単回皮下投与による赤血球造血促進作用[66277]
33
社内資料:正常ラットにおける間歇静脈内投与による赤血球造血促進作用:エポエチンアルファとの作用比較[66278]
34
社内資料:正常ラットにおける間歇静脈内投与による赤血球造血促進作用:エポエチンベータとの作用比較[66279]
35
社内資料:腎性貧血モデルラットにおける貧血改善作用:エポエチンアルファとの作用比較[66280]
36
社内資料:腎性貧血モデルラットにおける貧血改善作用:エポエチンベータとの作用比較[66281]
37
荒井弘文ほか:基礎と臨床. 1988; 22: 5531-5546[000956]
38
Nagano N, et al.:J Pharm Pharmacol. 1990; 42: 758-762[000957]
39
Koumegawa J, et al.:J Urology. 1991; 146: 1645-1649[000958]