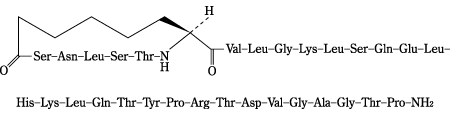
1
European Medicines Agency. “Assessment report for calcitonin containing medicinal products”.
2
U.S. Food and Drug Administration. “Background Document for Meeting of Advisory Committee for Reproductive Health Drugs and Drug Safety and Risk Management Advisory Committee”.
3
社内資料:エルカトニンのラットにおける皮下投与による12ヶ月慢性毒性試験
4
社内資料:92 week subcutaneous carcinogenicity study in mice
5
社内資料:薬物動態<血中濃度(筋肉内注射時)>
6
社内資料:薬物動態<血中濃度(点滴静注時)>
7
社内資料:薬物動態<体内分布、排泄>
8
墳本 敏彦他:現代の診療.1978;20(12):2223-2227
9
海上 寛他:骨代謝.1979;12:274-281
10
工藤 信一他:ホルモンと臨床.1979;27(2):179-183
11
三方 律治他:癌と臨床.1980;26(5):504-508
12
酒井 天栄他:ホルモンと臨床.1979;27(1):71-76
13
深見 敦夫他:新薬と臨牀.1979;28(1):110-112
14
有吉 寛他:新薬と臨牀.1979;28(4):681-683
15
成瀬 隆吉他:新薬と臨牀.1978;27(12):2213-2214
16
富田 明夫他:内科.1978;42(5):864-868
17
福永 仁夫他:医学のあゆみ.1978;104(7):468-470
18
鳥塚 莞爾他:クリニカ.1978;5(9):641-644
19
福永 仁夫他:臨床と研究.1979;56(11):3629-3636
20
池田 柊一他:臨床と研究.1979;56(4):1259-1261
21
富田 明夫他:基礎と臨床.1994;28(1):31-40
22
富田 明夫他:基礎と臨床.1994;28(1):41-57
23
桐山 健他:基礎と臨床.1994;28(1):59-71
24
土光 茂治他:医学のあゆみ.1978;106(1):33-36
25
土光 茂治他:日本整形外科学会雑誌.1979;53(8):937-947
26
高橋 貞雄他:臨床整形外科.1980;15(11):1050-1055
27
武藤 芳照他:整形外科.1981;32(10):1181-1184
28
小谷 勝他:現代の診療.1978;20(12):2217-2221
29
墳本 敏彦他:現代の診療.1978;20(10):1695-1700
30
墳本 敏彦他:現代の診療.1978;20(10):1701-1704
31
墳本 敏彦他:骨代謝.1979;12:373-377
32
常田 昌弘他:岐阜大学医学部紀要.1978;26(5):557-569
33
社内資料:薬効薬理<血清カルシウムに対する作用>
34
磯谷 幸宏他:日本薬理学雑誌.1995;105:199-208
35
岩田 剛典他:ホルモンと臨床.1995;43(2):195-198
36
桜田 豊三他:現代の診療.1978;20(12):2213-2216
37
平田 博則他:歯科基礎医学会雑誌.1979;21(1):177-181
38
山本 逸雄他:骨代謝.1979;12:385-391
39
社内資料:薬効薬理<骨吸収抑制作用>
40
Kaji H. et al.:Horm. Metab. Res.1993;25(8):421-424