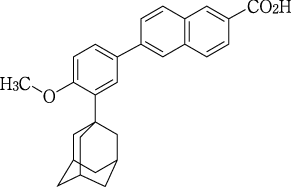
1
単回貼布及び光貼布試験(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.7.6.1)
2
薬物動態及び皮膚安全性試験(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.7.6.3)
3
川島眞ほか:皮膚の科学 2007;6:494-503
4
用量設定試験(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.7.2.2.4)
5
トレチノインゲル比較試験(海外)(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.7.6.12)
6
ラット単回塗布による吸収(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.3.2.2.1)
7
イヌ単回塗布による吸収(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.3.2.4.1)
8
ラット反復塗布による血漿中濃度(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.3.2.2.2)
9
ラット皮膚への分布及び代謝(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.4.1、2.6.4.5.1.2)
10
ラット単回及び反復塗布による組織分布(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.4.2.1.1)
11
マウス単回塗布による排泄(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.6.1.1.1)
12
ラット単回塗布による排泄(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.6.1.2.1)
13
ウサギ反復塗布による排泄(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.6.1.3.1)
14
イヌ単回塗布による排泄(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.6.1.4.1)
15
ラット腸肝循環(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.4.6.1.2.4)
16
社内資料:生物学的同等性試験
17
Kawashima, M. et al.:J. Dermatol. Sci. 2008;49:241-248
18
国内第Ⅲ相臨床試験(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.7.6.5)
19
国内第Ⅲ相臨床試験(長期投与試験)(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.7.6.6)
20
細胞核内レチノイン酸受容体結合(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.2.2.1.1)
21
RARサブタイプ別遺伝子転写促進化活性(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.2.2.1.2)
22
表皮トランスグルタミナーゼ発現(ディフェリンゲル:2008年7月16日承認、申請資料概要 2.6.2.2.2)