1
社内資料:ラットを用いた胚・胎児発生に関する試験(2015年7月3日承認、CTD2.6.6.6.3)
2
社内資料:ウサギを用いた胚・胎児発生に関する試験(2015年7月3日承認、CTD2.6.6.6.4)
3
社内資料:ラットを用いた出生前及び出生後の発生並びに母体の機能に関する試験(2015年7月3日承認、CTD2.6.6.6.5)
4
社内資料:新生児ラットを用いた毒性試験(2015年7月3日承認、CTD2.6.6.6.6)
5
Byrd,R.A.et al.:Endocrinology.2015;156(7):2417-2428
6
社内資料:日本人2型糖尿病患者を対象とした第III相臨床試験(GBDP試験)(2015年7月3日承認、CTD2.7.6.22)
7
社内資料:日本人2型糖尿病患者における第I相反復投与試験(2015年7月3日承認、CTD2.7.6.5)
8
社内資料:投与部位の影響を評価した試験(2015年7月3日承認、CTD2.7.6.1)
9
社内資料:絶対的バイオアベイラビリティを評価した試験(2015年7月3日承認、CTD2.7.6.2)
10
社内資料:腎機能障害患者における薬物動態試験(2015年7月3日承認、CTD2.7.6.6)
11
社内資料:肝機能障害患者における薬物動態試験(2015年7月3日承認、CTD2.7.6.8)
12
社内資料:高齢2型糖尿病患者における薬物動態試験(2015年7月3日承認、CTD2.7.6.7)
13
社内資料:アセトアミノフェンを用いた胃内容排出に対する影響を評価した試験(2015年7月3日承認、CTD2.7.6.17)
14
社内資料:リシノプリル及びメトプロロールとの薬物相互作用試験(2015年7月3日承認、CTD2.7.6.10)
15
社内資料:ワルファリンとの薬物相互作用試験(2015年7月3日承認、CTD2.7.6.13)
16
社内資料:シンチグラフィーを用いた胃内容排出に対する影響を評価した試験(2015年7月3日承認、CTD2.7.6.20)
17
社内資料:ジゴキシンとの薬物相互作用試験(2015年7月3日承認、CTD2.7.6.9)
18
社内資料:アトルバスタチンとの薬物相互作用試験(2015年7月3日承認、CTD2.7.6.11)
19
社内資料:経口避妊薬との薬物相互作用試験(2015年7月3日承認、CTD2.7.6.12)
20
社内資料:シタグリプチンとの薬物相互作用試験(2015年7月3日承認、CTD2.7.6.14)
21
Terauchi,Y.et al.:Endocrine Journal.2014;61(10):949-959
22
Miyagawa,J.et al.:Diabetes Obes.Metab.2015;17(10):974-983
23
Odawara,M.et al.:Diabetes Obes.Metab.2016;18(3):249-257
24
Araki,E.et al.:Diabetes Obes.Metab.2015;17(10):994-1002
25
Emoto,M.et al.:Endocrine Journal.2015;62(12):1101-1114
26
Ishii,H.et al.:Diabetes Ther. 2020;11(1):133-145
27
Glaesner,W.et al.:Diabetes Metab.Res.Rev.2010;26:287-296
28
田牧千裕ほか:日本薬理学雑誌.2015;146(4):215-224
29
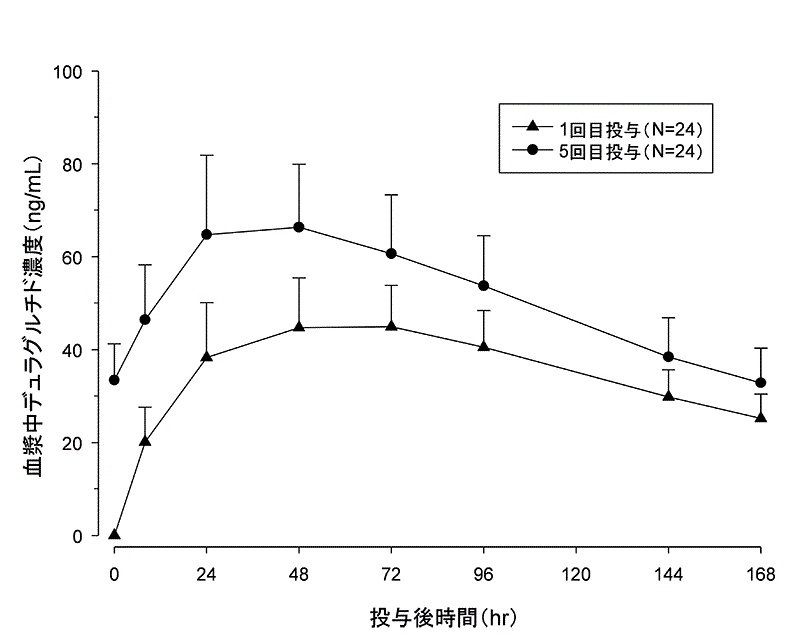
社内資料:日本人2型糖尿病患者における第I相単回投与試験(2015年7月3日承認、CTD2.7.6.4)
30
社内資料:第1相及び第2相インスリン分泌に対するデュラグルチドの影響を評価した試験(2015年7月3日承認、CTD2.7.6.18)
31
社内資料:外国人2型糖尿病患者を対象とした第III相臨床試験(2015年7月3日承認、CTD2.7.6.30)