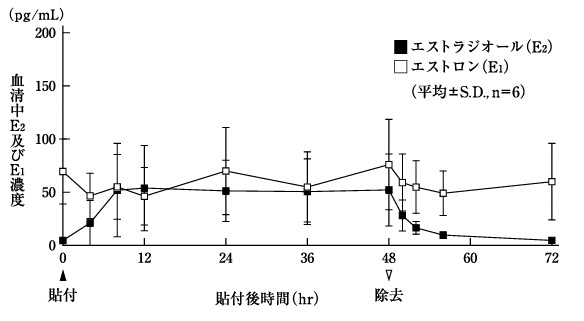
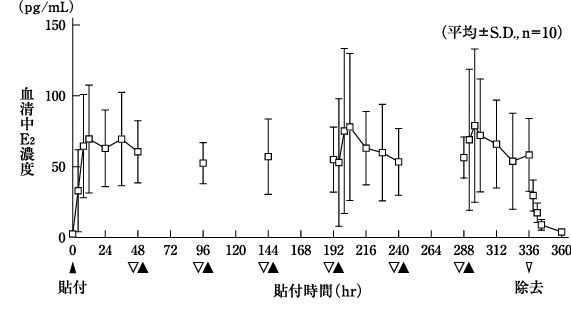
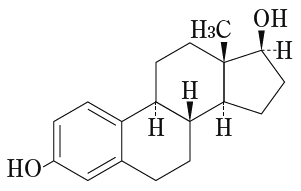
1
Holmberg L, et al.: Lancet 2004; 363(9407): 453-5.
2
Grady D, et al.: Obstet Gynecol 1995; 85(2): 304-13.
3
Chlebowski RT, et al.: JAMA 2003; 289(24): 3243-53.
4
Stefanick ML, et al.: JAMA 2006; 295(14): 1647-57.
5
Beral V, et al.: Lancet 2003; 362(9382): 419-27.
6
Manson JE, et al.: N Engl J Med 2003; 349(6): 523-34.
7
Anderson GL, et al.: JAMA 2004; 291(14): 1701-12.
8
Wassertheil-Smoller S, et al.: JAMA 2003; 289(20): 2673-84.
9
Hendrix SL, et al.: Circulation 2006; 113(20): 2425-34.
10
Shumaker SA, et al.: JAMA 2003; 289(20): 2651-62.
11
Rapp SR, et al.: JAMA 2003; 289(20): 2663-72.
12
Shumaker SA, et al.: JAMA 2004; 291(24): 2947-58.
13
Espeland MA, et al.: JAMA 2004; 291(24): 2959-68.
14
Rodriguez C, et al.: JAMA 2001; 285(11): 1460-5.
15
Lacey JV Jr, et al.: JAMA 2002; 288(3): 334-41.
16
Beral V, et al.: Lancet 2007; 369(9574): 1703-10.
17
Anderson GL, et al.: JAMA 2003; 290(13): 1739-48.
18
Cirillo DJ, et al.: JAMA 2005; 293(3): 330-9.
19
Beral V, et al.: Lancet 1997; 350(9084): 1047-59.
20
Farquhar C, et al.: Cochrane Database Syst Rev 2017; Issue 5.
21
Saito H, et al.: Human Reproduction 2019; 34(8): 1567-75.
22
中道昇: 臨床医薬 1996; 12(16): 3477-95.
23
中道昇: 臨床医薬 1996; 12(16): 3497-534.
24
友田豊 ほか: 臨床医薬 1996; 12(16): 3535-49.
25
武谷雄二 ほか: 臨床医薬 1996; 12(18): 4047-80.
26
武谷雄二 ほか: 臨床医薬 1996; 12(18): 4097-121.
27
伊吹令人 ほか: 臨床医薬 1996; 12(18): 4081-96.
28
久光製薬社内資料. 閉経後骨粗鬆症の臨床試験のまとめ(2002年4月11日承認、申請資料概要ト.2.1).
29
久光製薬社内資料. 卵巣摘出ラットの尾部皮膚温上昇に対する17β-estradiolの作用.
30
Steingold KA, et al.: J Clin Endocrinol Metab 1985; 61(4): 627-32.
31
Wronski TJ, et al.: Endocrinology 1988; 123(2): 681-6.
32
Gaumet N, et al.: Gerontology 1998; 44(3): 132-9.
33
Kimble RB, et al.: Endocrinology 1995; 136(7): 3054-61.
34
Kimble RB, et al.: J Biol Chem 1996; 271(46): 28890-7.
35
Jilka RL, et al.: Science 1992; 257(5066): 88-91.
36
Girasole G, et al.: J Clin Invest 1992; 89(3): 883-91.
37
Hughes DE, et al.: Nat Med 1996; 2(10): 1132-6.
38
Mano H, et al.: Biochem Biophys Res Commun 1996; 223(3): 637-42.