1
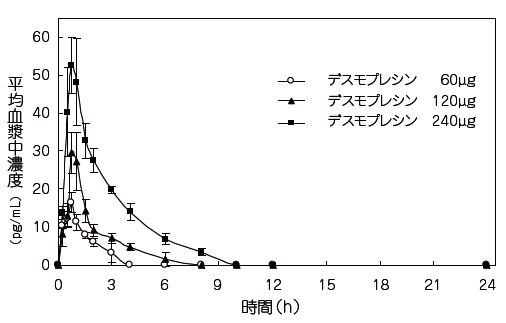
社内資料:健康成人における薬物動態及び薬力学的検討(2012年3月30日承認、CTD 2.7.6.6) [文献請求番号][FP08533][88649]
2
社内資料:薬物動態に及ぼす食事の影響(2012年12月21日承認、CTD 2.7.6.7) [文献請求番号][FP03785][88650]
3
社内資料:絶対的生物学的利用率(2012年3月30日承認、CTD 2.7.6.2) [文献請求番号][FP03780][88651]
4
西垣淳子,相原道明,向井真, 重松昭世, 桑原隆, 小林智.KW-8008の体内動態(I)- 125I-KW-8008のラットにおける単回鼻腔内投与後の吸収・分布・代謝および排泄 -.基礎と臨床.1995; 29(10): 2517-39. [文献請求番号][FP00484][88652]
5
社内資料:125I-KW-8008 の in vitro 蛋白結合(2012年3月30日承認、CTD 2.6.4.4.3) [文献請求番号][FP03766][88653]
6
社内資料:ヒト及びラット肝ミクロソームにおける代謝試験(2012年3月30日承認、CTD2.6.4.5.1) [文献請求番号][FP08531][88654]
7
社内資料:ラット臓器及び組織ホモジネートによる代謝試験(2012年3月30日承認、CTD2.6.4.5.2) [文献請求番号][FP08534][88655]
8
社内資料:腎機能障害患者における薬物動態への影響(2012年3月30日承認、CTD 2.7.6.12) [文献請求番号][FP03778][88656]
9
Callréus T, Lundahl J, Höglund P, Bengtsson P. Changes in gastrointestinal motility influence the absorption of desmopressin. Eur J Clin Pharmacol. 1999; 55(4): 305-9. [文献請求番号][FP01186][88657]
10
社内資料:男性患者国内第Ⅲ相試験(2019年6月18日承認、CTD 2.7.6.8) [文献請求番号][FP08523][88658]
11
社内資料:各種受容体に対する結合親和性(2012年3月30日承認、CTD 2.6.2.2.2) [文献請求番号][FP03768][88659]
12
社内資料:水及び尿素透過性亢進作用(2012年3月30日承認、CTD 2.6.2.2.3) [文献請求番号][FP03779][88661]
13
社内資料:水負荷ラットにおける抗利尿作用(2012年3月30日承認、CTD 2.6.2.2.4) [文献請求番号][FP03784][88662]