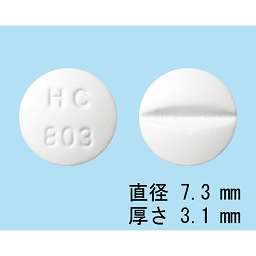
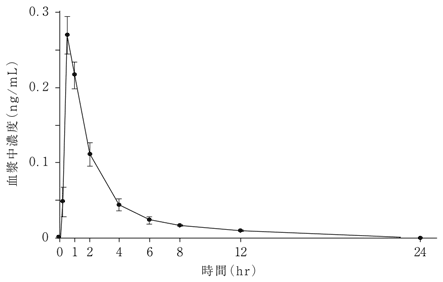
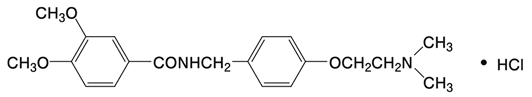
1
山田健久ほか.:薬物動態.1994;9(3):327-340
2
中島光好ほか.:薬理と治療.1993;21(11):4157-4173
3
社内資料:健康成人における血中濃度(食事の影響)(承認年月日:1995.6.30、申請資料概要ヘ.3.1.1)
4
山田健久ほか.:薬物動態.1994;9(3):308-326
5
山田健久ほか.:薬物動態.1996;11(2):139-146
6
T.Mushiroda,et al.:Drug Metab.Dispos.2000;28(10):1231-1237
7
社内資料:健康成人における代謝(尿中代謝物)(承認年月日:1995.6.30、申請資料概要ヘ.3.1.3)
8
三好秋馬ほか.:薬理と臨床.1993;3(11):2107-2128
9
三好秋馬ほか.:薬理と臨床.1994;4(2):261-279
10
Y.Iwanaga,et al.:Gastroenterology.1990;99:401-408
11
Y.Iwanaga,et al.:Jpn.J.Pharmacol.1996;71:129-137
12
原澤茂ほか.:薬理と治療.1993;21(11):4189-4195
13
Y.Iwanaga,et al.:Jpn.J.Pharmacol.1991;56:261-269