1
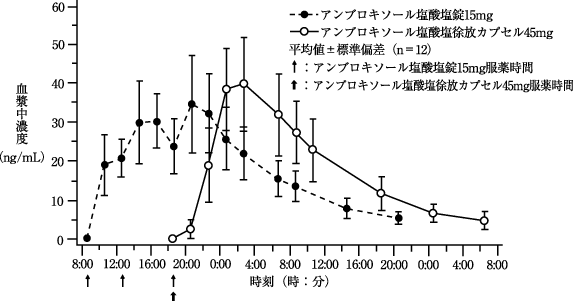
社内報告: 薬物動態(健康成人、夕食後単回投与). 1990.
2
社内報告: 薬物動態(健康成人、朝食後単回投与). 1989.
3
慶松元興ほか.: 新薬と臨牀. 2014; 63(12): 1964-80.
4
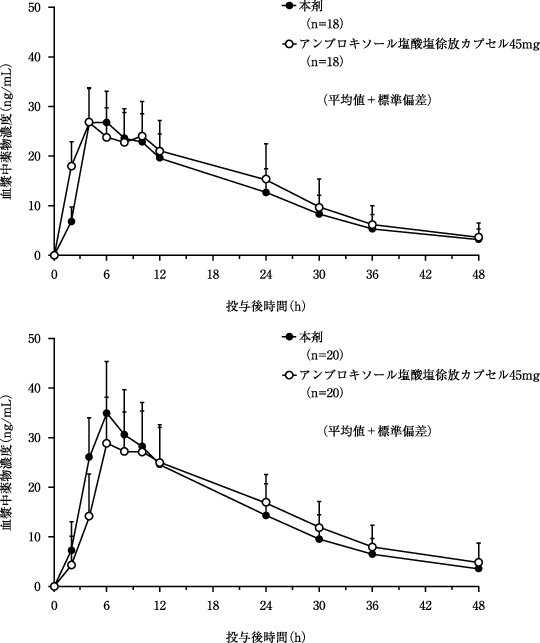
社内報告: 薬物動態(健康成人、連続投与). 1990.
5
原澤道美ほか.: Therapeutic Research. 1993; 14(1): 311-35.
6
長岡 滋ほか.: Therapeutic Research. 1993; 14(2): 617-46.
7
長岡 滋ほか.: 薬理と治療. 1981; 9(5): 1845-54.
8
社内報告: 肺表面活性物質の分泌促進作用(ラット). 1981.
9
社内報告: 肺表面活性物質の分泌促進作用(ラット、用量相関性). 1981.
10
千田勝一ほか.: 薬理と治療. 1981; 9(2): 483-6.
11
前多治雄ほか.: 薬理と治療. 1981; 9(2): 487-90.
12
Curti PC.: Pneumonologie. 1972; 147(1): 62-74.
13
Curti PC, et al.: Arzneim-Forsch. 1978; 28(5a): 922-5.
14
加瀬佳年ほか.: 熊本大学薬学部報告(未発表): 気道液分泌促進作用(ウサギ)、線毛運動亢進作用(ハト). 1980.