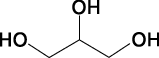
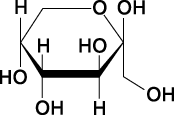
1
吉田一郎:別冊 日本臨牀 領域別症候群シリーズNo.18 先天代謝異常症候群. 1998:376-379
2
中村了正ほか:別冊 日本臨牀, 領域別症候群シリーズNo.18 先天代謝異常症候群. 1998:85-87
3
Hasegawa Y,et al.:Pediatrics International. 2003;45(1):5-9
4
高梨茂ほか:応用薬理. 1978;15(2):307-321
5
石井昌三ほか:新薬と臨牀. 1977;26(10):1791-1815
6
後藤文男ほか:臨牀と研究. 1978;55(7):2327-2335
7
高瀬正彌ほか:眼科臨床医報. 1981;75(4):476-486
8
河野親夫:臨床と研究. 1980;57(6):2017-2021
9
石川正恒ほか:脳神経外科. 1989;17(7):635-640
10
豊福秀尚:日本眼科学会雑誌. 1968;72(4):408-425
11
米田俊一ほか:日本外科宝函. 1977;46(6):731-739
12
湖崎弘ほか:眼科臨床医報. 1982;76(8):1068-1075
13
河瀬斌ほか:臨牀と研究. 1977;54(9):3068-3074
14
Meyer JS,et al.:Circulation. 1975;51:701-712
15
Ott EO,et al.:Neurology. 1974;24:1117-1126
16
Sloviter HA,et al.:Nature. 1966;210:1334-1336
17
Meyer JS,et al.:Stroke. 1972;3:168-180
18
野田行文ほか:新薬と臨牀. 1977;26(4):765-771
19
高野真:日本眼科学会雑誌. 1978:82(12):932-940
20
林成之ほか:新薬と臨牀. 1977;26(10):1817-1829
21
畑下鎮男:Neurol Med Chir. 1982;22:963-971
22
畑下鎮男:Neurol Med Chir. 1982;22:972-981