1
社内資料:Integrated Immunogenicity Report
2
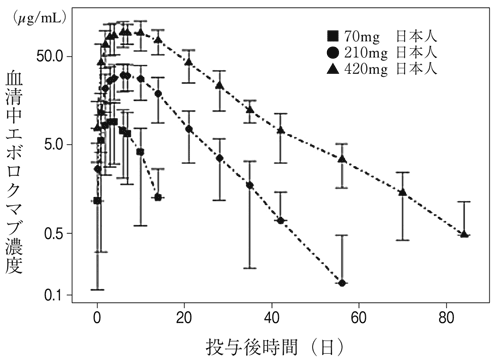
社内資料:20110121試験 日本人第Ⅰ相試験(2016年1月22日承認、CTD 2.7.6.10)
3
社内資料:20080397試験 海外第Ⅰ相試験(2016年1月22日承認、CTD 2.7.6.9)
4
社内資料:20110231試験 日本人第Ⅱ相試験(2016年1月22日承認、CTD 2.7.6.21)
5
社内資料:ポピュレーションPK試験報告書(2016年1月22日承認、CTD 2.7.2.3.5.8)
6
社内資料:20120341試験 肝機能障害患者における薬物動態(2016年1月22日承認、CTD 2.7.6.7)
7
社内資料:20140213試験 腎機能障害患者における薬物動態(2016年1月22日承認、CTD 2.7.6.8)
8
社内資料:20110168試験 生物学的同等性試験(2016年1月22日承認、CTD 2.7.6.1)
9
社内資料:20120122試験 日本人第Ⅲ相試験(2016年1月22日承認、CTD 2.7.6.22)
10
社内資料:20110110試験 国際共同長期投与試験(2016年1月22日承認、CTD 2.7.6.23)
11
社内資料:20120138試験 国際共同長期投与試験(2016年1月22日承認、CTD 2.7.6.24)
12
社内資料:20110271試験 家族性高コレステロール血症ホモ接合体患者を対象とした国際共同長期試験(2016年1月22日承認、CTD 2.7.6.28)
13
社内資料:20110233試験 家族性高コレステロール血症ホモ接合体患者を対象とした海外第Ⅱ/Ⅲ相試験(2016年1月22日承認、CTD 2.7.6.27)
14
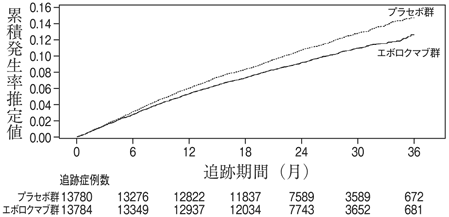
Sabatine MS, Giugliano RP, Keech AC, et al. :N Engl J Med 2017; 376:1713-1722.
15
社内資料:20110118試験 日本人結果報告書
16
社内資料:20140234試験 日本人第Ⅲ相試験(2019年6月18日承認、CTD 2.7.4.2 及びCTD 2.7.6.1)
17
社内資料:R20080178 ヒトPCSK9に対する結合親和性試験(2016年1月22日承認、CTD 2.6.2.2.1.1)
18
社内資料:R20080177 PCSK9とLDL受容体の結合に対する影響試験(2016年1月22日承認、CTD 2.6.2.2.1.2)
19
社内資料:R20080176 肝細胞へのLDLの取り込み試験(2016年1月22日承認、CTD 2.6.2.2.1.4)
20
社内資料:R20080179 ハムスターにおける血清コレステロールと肝臓LDL受容体に対する作用(2016年1月22日承認、CTD 2.6.2.2.2.1)
21
社内資料:R20090025 カニクイザルの血清脂質に対する作用(2016年1月22日承認、CTD 2.6.2.2.2.2)