1
笹原邦宏ほか:臨床医薬 1988;4(1):45-65
2
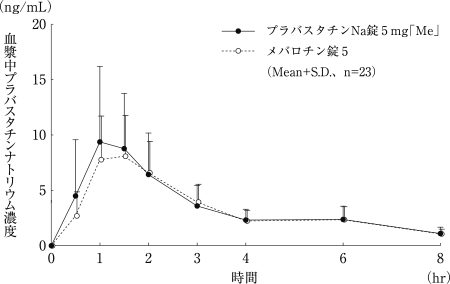
社内資料:プラバスタチンNa錠5mg「Me」の生物学的同等性試験に関する資料
3
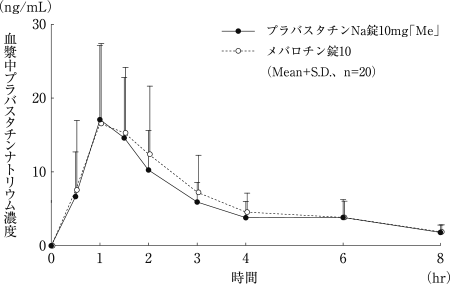
社内資料:プラバスタチンNa錠10mg「Me」の生物学的同等性試験に関する資料
4
Komai T, et al.:Eur J Drug Metab Pharmacokinet. 1992;17(2):103-113
5
Muramatsu S, et al.:Xenobiotica 1992;22(5):487-498
6
Everett DW, et al.:Drug Metab Dispos. 1991;19(4):740-748
7
石神未知ほか:Prog Med. 1998;18(5):972-980
8
Tsujita Y, et al.:Ann Rep Sankyo Res Lab. 1997;49:1-61
9
Neuvonen PJ, et al.:Clin Pharmacol Ther. 1998;63(3):332-341
10
Azie NE, et al.:Clin Pharmacol Ther. 1998;64(4):369-377
11
Fukazawa I, et al.:Br J Clin Pharmacol. 2004;57(4):448-455
12
中谷矩章ほか:臨床医薬 1988;4(2):201-227
13
中谷矩章ほか:臨床医薬 1991;7(4):745-769
14
八杉忠男ほか:臨床評価 1988;16(2):211-249
15
五島雄一郎ほか:医学のあゆみ 1988;146(13):927-955
16
中谷矩章ほか:臨床医薬 1990;6(9):1803-1828
17
松沢佑次ほか:臨床評価 1991;19(1):47-92
18
山本 章ほか:臨床医薬 1988;4(3):409-437
19
齋藤 康ほか:臨床医薬 1991;7(4):771-797
20
馬渕 宏ほか:Geriat Med. 1996;34(3):339-362
21
中谷矩章ほか:Geriat Med. 1996;34(3):363-379
22
Nakamura H, et al.:Lancet 2006;368(9542):1155-1163
23
和田英夫ほか:臨床医薬 1988;4(11):2149-2160
24
井藤英喜:臨床医薬 1988;4(3):395-407
25
梶山梧朗ほか:臨床医薬 1988;4(2):191-200
26
芳野 原ほか:糖尿病 1988;31(5):385-391
27
塩 宏:臨床医薬 1988;4(6):1041-1050
28
Tsujita Y, et al.:Biochim Biophys Acta. 1986;877(1):50-60
29
Kita T, et al.:Drugs Affecting Lipid Metabolism 1987:251-254
30
Watanabe Y, et al.:Biochim Biophys Acta. 1988;960(3):294-302