1
社内資料:生物学的同等性試験(100mg)
2
第十八改正日本薬局方解説書 2021;C2450-2460
3
社内資料:生物学的同等性試験(200mg)
持続性Ca拮抗剤
1カプセル 10.1円
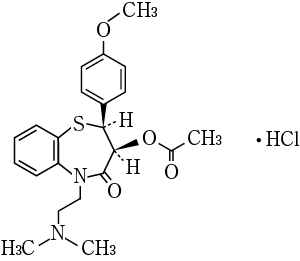
| 有効成分 (1カプセル中) | 日局 ジルチアゼム塩酸塩 100mg |
|---|---|
| 添加剤 | 乳糖水和物、結晶セルロース、ヒプロメロース、マクロゴール6000、アンモニオアルキルメタクリレートコポリマー、タルク、ステアリン酸、ゼラチン、ラウリル硫酸ナトリウム |
| 有効成分 (1カプセル中) | 日局 ジルチアゼム塩酸塩 200mg |
|---|---|
| 添加剤 | 乳糖水和物、結晶セルロース、ヒプロメロース、マクロゴール6000、アンモニオアルキルメタクリレートコポリマー、タルク、ステアリン酸、ゼラチン、ラウリル硫酸ナトリウム |
| 性状 | キャップ、ボディとも白色不透明の硬カプセル剤 |
|---|---|
| 外形 |  |
| 大きさ | 長径:約17.7mm 短径:約6.3mm |
| 重量 | 約309mg |
| 性状 | キャップ、ボディとも白色不透明の硬カプセル剤 |
|---|---|
| 外形 |  |
| 大きさ | 長径:約21.8mm 短径:約 7.6mm |
| 重量 | 約594mg |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
アスナプレビル(スンベプラ) ダクラタスビル塩酸塩/アスナプレビル/ベクラブビル塩酸塩(ジメンシー) | アスナプレビルの血中濃度が上昇する。 肝胆道系の副作用が発現し、また重症化するおそれがある。 | 本剤がCYP3Aを阻害することにより、左記薬剤の代謝が阻害される。 |
イバブラジン塩酸塩(コララン) | 過度の徐脈があらわれることがある。 | 本剤がCYP3Aを阻害することにより、左記薬剤の代謝が阻害され、血中濃度が上昇する。 左記薬剤の心拍数減少作用を相加的に増強する。 |
ロミタピドメシル酸塩(ジャクスタピッド) | ロミタピドメシル酸塩の血中濃度が著しく上昇するおそれがある。 | 本剤がCYP3Aを阻害することにより、左記薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
降圧作用を有する薬剤(降圧剤、硝酸剤等) | 定期的に血圧を測定し、用量を調節する。 | 相加的に作用(降圧作用)を増強させると考えられる。 |
β遮断剤(ビソプロロールフマル酸塩、プロプラノロール塩酸塩、アテノロール等) | 徐脈、房室ブロック、洞房ブロック等があらわれることがある。 定期的に脈拍数を測定し、必要に応じて心電図検査を行い、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用、陰性変力作用、降圧作用)を増強させると考えられる。特にジギタリス製剤との3剤併用時には注意を要する。 |
ラウオルフィア製剤(レセルピン等) | 徐脈、房室ブロック、洞房ブロック等があらわれることがある。 定期的に脈拍数を測定し、必要に応じて心電図検査を行い、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用、陰性変力作用、降圧作用)を増強させると考えられる。特にジギタリス製剤との3剤併用時には注意を要する。 |
ジギタリス製剤(ジゴキシン、メチルジゴキシン) | 徐脈、房室ブロック等があらわれることがある。また、これらの不整脈を含めジギタリス製剤の血中濃度上昇による中毒症状(悪心・嘔吐、頭痛、めまい、視覚異常等)があらわれることがある。 定期的にジギタリス中毒の有無の観察、心電図検査を行い、必要に応じてジギタリス製剤の血中濃度を測定し、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用)を増強させると考えられる。特にβ遮断剤との3剤併用時には注意を要する。 また、本剤はジギタリス製剤の血中濃度を上昇させると考えられる。 |
抗不整脈薬(アミオダロン塩酸塩、メキシレチン塩酸塩等) | 徐脈、房室ブロック、洞停止等があらわれることがある。 定期的に脈拍数を測定し、必要に応じて心電図検査を行い、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用)を増強させると考えられる。 |
麻酔剤(イソフルラン等) | 徐脈、房室ブロック、洞停止等があらわれることがある。 心電図をモニターし、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用)を増強させると考えられる。 |
フィンゴリモド塩酸塩 | フィンゴリモド塩酸塩の投与開始時に併用すると重度の徐脈や心ブロックが認められることがある。 | 共に徐脈や心ブロックを引き起こすおそれがある。 |
アプリンジン塩酸塩 | 両剤の血中濃度上昇による症状(徐脈、房室ブロック、洞停止、振戦、めまい、ふらつき等)があらわれることがある。 定期的に臨床症状を観察し、必要に応じて心電図検査を行い、異常が認められた場合には減量若しくは投与を中止する。 | 共通の代謝酵素(チトクロームP450)に影響を及ぼし合い、両剤の血中濃度を上昇させると考えられる。 |
ジヒドロピリジン系Ca拮抗剤(ニフェジピン、アムロジピンベシル酸塩等) | ジヒドロピリジン系Ca拮抗剤の血中濃度上昇による症状(降圧作用の増強等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
シンバスタチン | シンバスタチンの血中濃度上昇による横紋筋融解症やミオパシーが発現することがある。 定期的に臨床症状を観察し、異常が認められた場合には投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
トリアゾラム | トリアゾラムの血中濃度上昇による症状(睡眠時間の延長等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
ミダゾラム | ミダゾラムの血中濃度上昇による症状(鎮静・睡眠作用の増強等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
カルバマゼピン | カルバマゼピンの血中濃度上昇による症状(眠気、悪心・嘔吐、眩暈等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
セレギリン塩酸塩 | セレギリン塩酸塩の作用、毒性が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
テオフィリン | テオフィリンの血中濃度上昇による症状(悪心・嘔吐、頭痛、不眠等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
シロスタゾール | シロスタゾールの作用が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
アピキサバン | アピキサバンの作用が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
ビノレルビン酒石酸塩 | ビノレルビン酒石酸塩の作用が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
シクロスポリン | シクロスポリンの血中濃度上昇による症状(腎障害等)があらわれることがある。 定期的に臨床症状を観察し、また、シクロスポリンの血中濃度を測定し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
タクロリムス水和物 | タクロリムスの血中濃度上昇による症状(腎障害等)があらわれることがある。 定期的に臨床症状を観察し、また、タクロリムスの血中濃度を測定し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
フェニトイン | フェニトインの血中濃度上昇による症状(運動失調、めまい、眼振等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 また、本剤の作用が低下することがある。 | フェニトインの代謝酵素(チトクロームP450)を阻害することにより、フェニトインの血中濃度を上昇させると考えられる。また、フェニトインが本剤の代謝を促進することにより、本剤の血中濃度を低下させると考えられる。 |
シメチジン | 本剤の血中濃度上昇による症状(降圧作用の増強、徐脈等)があらわれることがある。 定期的に臨床症状を観察し、必要に応じて心電図検査を行い、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤が本剤の代謝酵素(チトクロームP450)を阻害することにより、本剤の血中濃度を上昇させると考えられる。 |
HIVプロテアーゼ阻害剤(リトナビル、サキナビルメシル酸塩等) | 本剤の血中濃度上昇による症状(降圧作用の増強、徐脈等)があらわれることがある。 定期的に臨床症状を観察し、必要に応じて心電図検査を行い、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤が本剤の代謝酵素(チトクロームP450)を阻害することにより、本剤の血中濃度を上昇させると考えられる。 |
リファンピシン | 本剤の作用が低下することがある。 定期的に臨床症状を観察し、また、可能であれば本剤の血中濃度を測定し、異常が認められた場合には、他剤への変更あるいは本剤を増量するなどの適切な処置を行う。 | リファンピシンが本剤の代謝酵素(チトクロームP450)を誘導することにより、本剤の血中濃度を低下させると考えられる。 |
筋弛緩剤(パンクロニウム臭化物、ベクロニウム臭化物等) | 筋弛緩剤の作用が増強することがある。 筋弛緩作用に注意し、異常が認められた場合には減量若しくは投与を中止する。 | 本剤が神経筋接合部において、シナプス前からのアセチルコリン放出を抑制させると考えられる。 |
0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
循環器 | 徐脈、房室ブロック、顔面潮紅、めまい、動悸、浮腫 | 洞停止、血圧低下、胸痛 | 洞房ブロック |
精神神経系 | 倦怠感、頭痛、頭重感、脱力感、眠気、不眠 | パーキンソン様症状、こむらがえり | |
肝臓 | AST上昇、ALT上昇 | 黄疸 | ALP上昇、LDH上昇、γ-GTP上昇、肝腫大 |
過敏症 | 発疹、そう痒、多形性紅斑様皮疹 | 蕁麻疹 | 光線過敏症、膿疱 |
消化器 | 胃部不快感、便秘、腹痛、胸やけ、嘔気、軟便、下痢、口渇 | 食欲不振 | |
血液 | 血小板減少、白血球減少 | ||
その他 | 歯肉肥厚、女性化乳房、しびれ |
判定パラメータ | 参考パラメータ | ||||
AUC(ng・hr/mL) | Cmax(ng/mL) | MRT(hr) | Tmax(hr) | t1/2(hr) | |
ジルチアゼム塩酸塩徐放カプセル100mg「トーワ」 | 609.8±77.2 | 40.22±5.60 | 13.96±0.54 | 9.3±0.5 | 6.82±0.36 |
ヘルベッサーRカプセル100mg | 623.1±69.4 | 41.33±5.51 | 14.14±0.74 | 9.5±0.9 | 7.14±0.52 |
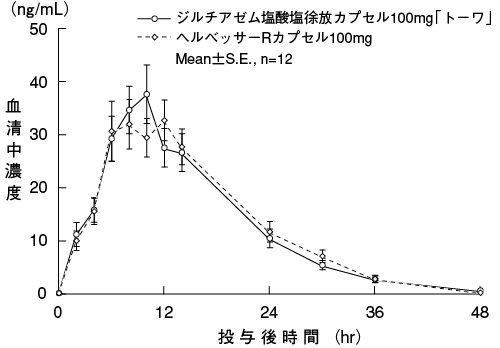
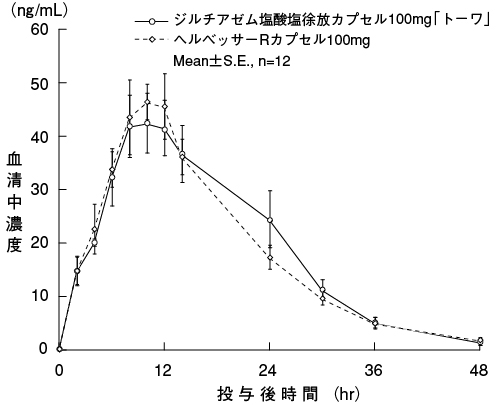
判定パラメータ | 参考パラメータ | ||||
AUC(ng・hr/mL) | Cmax(ng/mL) | MRT(hr) | Tmax(hr) | t1/2(hr) | |
ジルチアゼム塩酸塩徐放カプセル100mg「トーワ」 | 916.7±120.2 | 49.94±5.50 | 15.84±0.70 | 10.7±0.8 | 7.38±0.59 |
ヘルベッサーRカプセル100mg | 875.2±110.6 | 51.55±6.18 | 15.44±0.74 | 10.2±0.5 | 7.74±0.45 |
 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379