1
阿部真也 他:周産期医学. 2017;47:1353-1355.
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌. 2021;29:49-54.
3
堀本政夫 他:応用薬理. 1991;42(2):167-176.
4
Naito T. et al. :J. Hum. Lact. 2015;31(2):301-306.
5
桑島巌 他:老年医学. 1991;29(6):899-902.
6
Laine K. et al. :Br. J. Clin. Pharmacol. 1997;43:29-33.
7
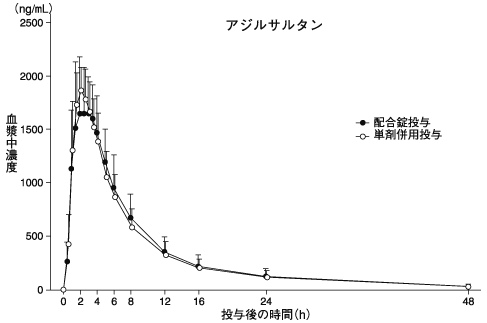
アジルサルタン/アムロジピン配合錠の薬物動態試験成績①(2014年3月24日承認、CTD 2.7.6.3)
8
アジルサルタン/アムロジピン配合錠の薬物動態試験成績②(2014年3月24日承認、CTD 2.7.6.1)
9
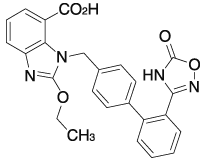
アジルサルタンの代謝に関する検討①(2012年1月18日承認、CTD 2.6.4.1)
10
アジルサルタンの代謝に関する検討②(2012年1月18日承認、CTD 2.6.2.1)
11
アジルサルタンの腎機能障害患者における薬物動態試験成績(2012年1月18日承認、CTD 2.7.2.2)
12
アジルサルタンの臨床試験成績①(2012年1月18日承認、CTD 2.7.2.2)
13
アジルサルタンの肝機能障害者における薬物動態試験成績(2012年1月18日承認、CTD 2.7.6.17)
14
足立幸彦 他:薬理と治療. 1991;19(7):2923-2932.
15
アジルサルタンの薬物動態試験成績①(2012年1月18日承認、CTD 2.7.6.15)
16
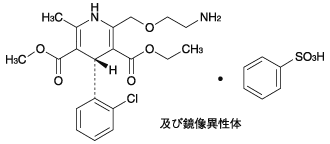
アジルサルタンとアムロジピンの薬物相互作用試験成績(2014年3月24日承認、CTD 2.7.6.5)
17
アジルサルタンとフルコナゾールとの薬物相互作用試験成績(2012年1月18日承認、CTD 2.7.6.18)
18
アジルサルタン/アムロジピン配合錠の臨床試験成績①(2014年3月24日承認、CTD 2.7.6.7)
19
アジルサルタン/アムロジピン配合錠の臨床試験成績②(2014年3月24日承認、CTD 2.7.6.8)
20
山中教造 他:日薬理誌. 1991;97:167-178.
21
アジルサルタンの薬物動態試験成績②(2012年1月18日承認、CTD 2.7.6.5)





 274
274