1
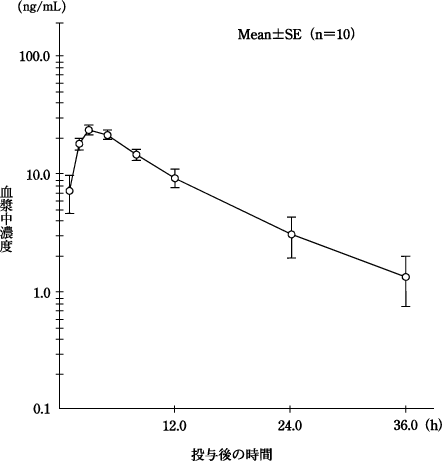
田辺三菱製薬(株):エチゾラムの薬物動態に関わる資料1(社内資料)
2
田辺三菱製薬(株):エチゾラムの薬物動態に関わる資料2(社内資料)
3
Kato Y, et al.:Arzneimittelforschung. 1978;28(7):1170-1173
4
田辺三菱製薬(株):エチゾラムの薬物動態に関わる資料5(社内資料)
5
田辺三菱製薬(株):エチゾラムの薬物動態に関わる資料3(社内資料)
6
田辺三菱製薬(株):エチゾラムの薬物動態に関わる資料4(社内資料)
7
葉田 裕:臨床精神医学. 1979;8(1):111-131
8
山内育郎, 他:新薬と臨床. 1979;28(7):1135-1145
9
鈴木仁一, 他:臨床と研究. 1979;56(10):3425-3442
10
並木正義, 他:臨床と研究. 1982;59(12):4101-4112
11
鈴木仁一, 他:臨床と研究. 1982;59(11):3797-3808
12
室 捷之, 他:新薬と臨床. 1978;27(8):1407-1422
13
小島卓也, 他:臨床精神医学. 1983;12(10):1293-1314
14
Itil TM, et al.:Psychopharmacol Bull. 1982;18(4):165-172
15
斎藤正己, 他:脳波と筋電図. 1976;4(1):27-40
16
Nakazawa Y, et al.:Psychopharmacologia. 1975;44(2):165-171
17
Tsumagari T, et al.:Arzneimittelforschung. 1978;28(7):1158-1164
18
Setoguchi M, et al.:Arzneimittelforschung. 1978;28(7):1165-1169
19
田辺三菱製薬(株):エチゾラムの薬効薬理に関わる資料1(社内資料)
20
田辺三菱製薬(株):エチゾラムの薬効薬理に関わる資料2(社内資料)
21
田辺三菱製薬(株):エチゾラムの薬効薬理に関わる資料5(社内資料)
22
田辺三菱製薬(株):エチゾラムの薬効薬理に関わる資料3(社内資料)
23
田辺三菱製薬(株):エチゾラムの薬効薬理に関わる資料4(社内資料)