1
阿部真也ほか:周産期医学 2017;47:1353-1355
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌 2021;29:49-54
3
Naito T, et al.:J Hum Lact. 2015;31(2):301-306
4
Stangier J, et al.:J Clin Pharmacol. 2000;40:1373-1379
5
Makani H, et al.:BMJ. 2013;346:f360
6
Laine K, et al.:Br J Clin Pharmacol. 1997 ; 43 (1):29-33
7
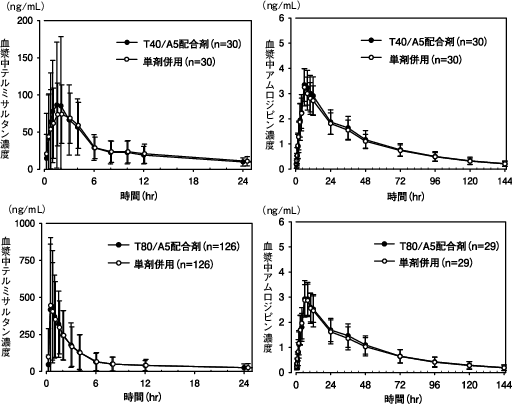
社内資料:岩井孝一ほか:相対バイオアベイラビリティ試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.7.6.1.1、2.7.1)
8
社内資料:村井雅子ほか:相対バイオアベイラビリティ試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.7.6.1.2、2.7.1)
9
社内資料:三田哲也ほか:健康成人での薬物動態試験
10
社内資料:岩井孝一ほか:健康成人での薬物動態試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.7.6.2、2.7.2)
11
Stangier J, et al.:J Clin Pharmacol. 2000;40:1347-1354
12
社内資料:H Narjes, et al.:健康成人での薬物動態試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.7.6.2.3、2.7.2)
13
社内資料:茶珍元彦ほか:食事の影響試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.7.6.1.3、2.7.1)
14
社内資料:Busch U, et al.:血漿蛋白結合率試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要 添付資料ヘ-17~20)
15
社内資料:Françoise B.:血漿蛋白結合率試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要 添付資料ヘ-17~20)
16
社内資料:山下和宏ほか:血漿蛋白結合率試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要 添付資料ヘ-17~20)
17
社内資料:美馬康史ほか:ミカルディス錠20mgと錠40mg含量が異なる製剤の生物学的同等性の評価
18
Stangier J, et al.:J Clin Pharmacol. 2000;40:1312-1322
19
社内資料:肝機能障害患者の薬物動態試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要 添付資料ト-27)
20
社内資料:岡崎浩太郎ほか:検証試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.7.6.3.1)
21
社内資料:村井雅子ほか:検証試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.7.6.3.2)
22
社内資料:坂本祐史ほか:検証試験
23
社内資料:坂本祐史ほか:比較試験
24
社内資料:黒木大介ほか:長期投与試験
25
Wienen W.:Br J Pharmacol. 1993;110(1):245-252
26
Wienen W.:Cardiovascular Drug Reviews 2000;18(2):127-154
27
社内資料:Entzeroth M.:アンジオテンシンⅡ受容体(AT1、AT2)に対する親和性(in vitro試験)
28
社内資料:Wienen W.:アンジオテンシンⅡ拮抗作用(in vitro試験)
29
Yamada S, et al.:J Cardiovasc Pharmacol. 1994;23(3):466-472
30
山中教造ほか:日本薬理学雑誌 1991;97(3):167-178
31
Burges RA, et al.:J Cardiovasc Pharmacol. 1987;9(1):110-119
32
社内資料:Katalin K, et al.:血圧の併用試験(ミカムロ配合錠:2010年7月23日承認、CTD 2.6.2.2.3)