1
阿部真也 他:周産期医学. 2017;47:1353-1355
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌. 2021;29:49-54
3
大島洋次郎 他:薬理と治療. 1996;24:S875-S888
4
第十八改正日本薬局方解説書 廣川書店 2021;C1455- C1461
5
社内資料:生物学的同等性試験(OD錠8mg)
6
社内資料:生物学的同等性試験(OD錠12mg)
7
社内資料:生物学的同等性試験(OD錠2mg)
8
社内資料:生物学的同等性試験(OD錠4mg)
持続性アンジオテンシンⅡ受容体拮抗剤
1錠 13円
有効成分 | 1錠中 カンデサルタン シレキセチル 2.0mg |
|---|---|
添加剤 | ポリビニルアルコール(部分けん化物)、乳糖水和物、ジメチルポリシロキサン(内服用)、軽質無水ケイ酸、トウモロコシデンプン、ポリビニルアルコール・ポリエチレングリコール・グラフトコポリマー、カルナウバロウ |
有効成分 | 1錠中 カンデサルタン シレキセチル4.0mg |
|---|---|
添加剤 | ポリビニルアルコール(部分けん化物)、乳糖水和物、ジメチルポリシロキサン(内服用)、軽質無水ケイ酸、トウモロコシデンプン、ポリビニルアルコール・ポリエチレングリコール・グラフトコポリマー、カルナウバロウ |
有効成分 | 1錠中 カンデサルタン シレキセチル 8.0mg |
|---|---|
添加剤 | ポリビニルアルコール(部分けん化物)、乳糖水和物、三二酸化鉄、黄色三二酸化鉄、ジメチルポリシロキサン(内服用)、軽質無水ケイ酸、トウモロコシデンプン、ポリビニルアルコール・ポリエチレングリコール・グラフトコポリマー、カルナウバロウ |
有効成分 | 1錠中 カンデサルタン シレキセチル 12.0mg |
|---|---|
添加剤 | ポリビニルアルコール(部分けん化物)、乳糖水和物、三二酸化鉄、黄色三二酸化鉄、ジメチルポリシロキサン(内服用)、軽質無水ケイ酸、トウモロコシデンプン、ポリビニルアルコール・ポリエチレングリコール・グラフトコポリマー、酸化チタン、カルナウバロウ |
| 剤形 | 口腔内崩壊錠、フィルムコーティング錠 |
|---|---|
| 色調 | 白色~帯黄白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 7.0mm 大きさ(厚さ) 3.2mm |
| 質量 | 120mg |
| 本体表示 | カンデサルタン EE 2 カンデサルタン OD 2 |
| 剤形 | 割線入りの口腔内崩壊錠、フィルムコーティング錠 |
|---|---|
| 色調 | 白色~帯黄白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 7.0mm 大きさ(厚さ) 3.4mm |
| 質量 | 120mg |
| 本体表示 | カンデサルタン EE 4 カンデサルタン OD 4 |
| 剤形 | 割線入りの口腔内崩壊錠、フィルムコーティング錠 |
|---|---|
| 色調 | ごくうすいだいだい色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 8.0mm 大きさ(厚さ) 3.8mm |
| 質量 | 173mg |
| 本体表示 | カンデサルタン EE 8 カンデサルタン OD 8 |
| 剤形 | 割線入りの口腔内崩壊錠、フィルムコーティング錠 |
|---|---|
| 色調 | うすいだいだい色 |
| 外形 | 表面  裏面  側面 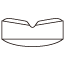 |
| 大きさ | 大きさ(直径) 8.5mm 大きさ(厚さ) 3.9mm |
| 質量 | 203mg |
| 本体表示 | カンデサルタン EE 12 カンデサルタン OD 12 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
アリスキレンフマル酸塩 ラジレス (糖尿病患者に使用する場合。ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く。) | 非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加が報告されている。 | レニン-アンジオテンシン系阻害作用が増強される可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
カリウム保持性利尿剤 スピロノラクトン トリアムテレン等 エプレレノン カリウム補給剤 | 血清カリウム値が上昇することがある。 | 本剤のアルドステロン分泌抑制作用によりカリウム貯留作用が増強することによる。 危険因子:特に腎機能障害のある患者 |
利尿剤 フロセミド トリクロルメチアジド等 | 利尿剤で治療を受けている患者に本剤を初めて投与する場合、降圧作用が増強するおそれがあるので、少量から開始するなど慎重に投与すること。 | 利尿剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。 危険因子:特に最近利尿剤投与を開始した患者 |
アリスキレンフマル酸塩 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については、治療上やむを得ないと判断される場合を除き避けること。 | レニン-アンジオテンシン系阻害作用が増強される可能性がある。 |
アンジオテンシン変換酵素阻害剤 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。 | レニン-アンジオテンシン系阻害作用が増強される可能性がある。 |
リチウム | リチウム中毒が報告されている。 | 腎尿細管におけるリチウムの再吸収が促進される。 |
次の薬剤により併用治療されている場合 (1)アンジオテンシン変換酵素阻害剤及びβ遮断剤 (2)ループ利尿剤及びカリウム保持性利尿剤 | 慢性心不全の臨床試験では、左記の併用に加え更に本剤を併用すると、立ちくらみ、ふらつき及び低血圧の発現頻度が高く、かつ程度が高い。 腎機能低下あるいは貧血を起こすおそれがある。 | (1)レニン-アンジオテンシン系阻害作用が増強される可能性がある。 (2)利尿剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。 危険因子:厳重な減塩療法中の患者、低ナトリウム血症の患者、低血圧の患者、NYHA心機能分類Ⅲ等の比較的重症度の高い慢性心不全患者、腎障害のある患者、血液透析中の患者 |
非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 降圧作用が減弱することがある。 | 非ステロイド性消炎鎮痛剤は血管拡張作用を有するプロスタグランジンの合成を阻害することから、降圧作用を減弱させる可能性があると考えられている。 |
非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 腎障害のある患者では、さらに腎機能が悪化するおそれがある。 | 非ステロイド性消炎鎮痛剤のプロスタグランジン合成阻害作用により、腎血流量が低下するためと考えられている。 |
0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹、湿疹、蕁麻疹、そう痒、光線過敏症 | ||
循環器 | めまい、ふらつき、立ちくらみ、動悸、ほてり | 期外収縮、心房細動 | |
精神神経系 | 頭痛、頭重感、不眠、眠気、舌のしびれ感 | 四肢のしびれ感 | |
消化器 | 悪心、嘔吐、食欲不振、胃部不快感、心窩部痛、下痢、口内炎 | 味覚異常 | |
肝臓 | AST、ALT、Al-P、LDH、γ-GTPの上昇 | ||
血液 | 貧血、白血球減少、白血球増多、好酸球増多、血小板減少 | ||
腎臓 | BUN、クレアチニンの上昇、蛋白尿 | ||
その他 | 倦怠感、脱力感、鼻出血、頻尿、浮腫、咳、血中カリウム上昇、総コレステロール上昇、血中CK上昇、CRP上昇、血中尿酸上昇、血清総タンパク減少 | 低ナトリウム血症、腰背部痛、筋肉痛 | 耳鳴 |
5%以上 | 0.1~5%未満 | |
|---|---|---|
過敏症 | 発疹、そう痒 | |
循環器 | 立ちくらみ、低血圧、ふらつき | めまい、徐脈、動悸、期外収縮、ほてり |
精神神経系 | 頭痛、眠気、不眠、頭重感、しびれ感 | |
消化器 | 悪心、心窩部痛、便秘、胃潰瘍、口渇、味覚異常、嘔吐、食欲不振、胃部不快感 | |
肝臓 | γ-GTP上昇 | ALT、AST、LDH、Al-Pの上昇 |
血液 | 貧血 | 白血球減少、好酸球増多、白血球増多、血小板減少 |
腎臓 | BUN、クレアチニンの上昇 | 蛋白尿 |
その他 | 血中カリウム上昇、血中尿酸上昇、血中CK上昇 | 倦怠感、脱力感、咳、浮腫、視覚異常、総コレステロール上昇、低ナトリウム血症、血清総タンパク減少 |
判定パラメータ | 参考パラメータ | |||
AUC0→48hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
カンデサルタンOD錠8mg「EE」 | 980.6±279.3 | 80.2±22.8 | 5.4±1.3 | 9.9±2.6 |
ブロプレス錠8 | 967.9±265.3 | 77.9±25.3 | 4.8±1.5 | 11.1±4.0 |
判定パラメータ | 参考パラメータ | |||
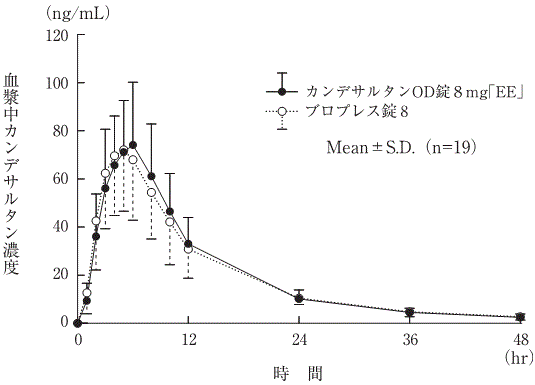
AUC0→48hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
カンデサルタンOD錠8mg「EE」 | 1055.0±267.0 | 82.3±23.4 | 5.5±1.4 | 9.3±2.0 |
ブロプレス錠8 | 1046.7±226.7 | 76.0±20.3 | 5.0±1.2 | 11.3±4.9 |
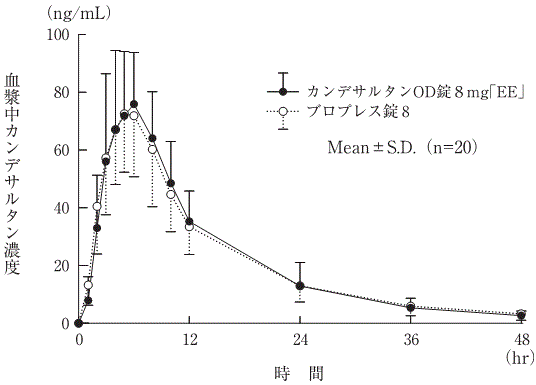
判定パラメータ | 参考パラメータ | |||
AUC0→48hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
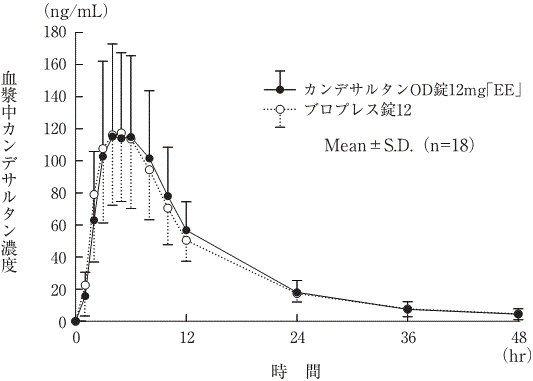
カンデサルタンOD錠12mg「EE」 | 1615.7±304.2 | 136.0±33.8 | 4.5±1.8 | 10.1±3.3 |
ブロプレス錠12 | 1631.1±360.5 | 128.0±28.0 | 4.6±1.1 | 9.2±2.3 |
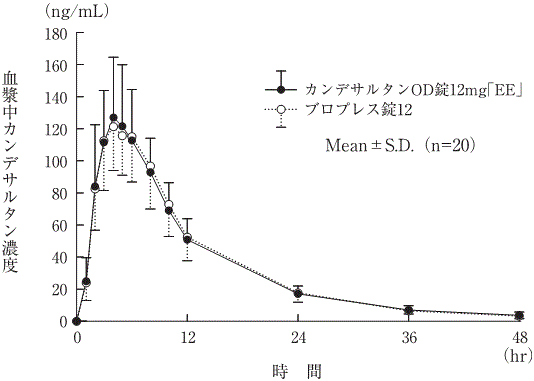
判定パラメータ | 参考パラメータ | |||
AUC0→48hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
カンデサルタンOD錠12mg「EE」 | 1657.2±510.8 | 131.0±55.1 | 5.2±1.8 | 9.8±3.0 |
ブロプレス錠12 | 1610.0±449.7 | 124.3±43.9 | 5.1±1.7 | 12.3±8.7 |