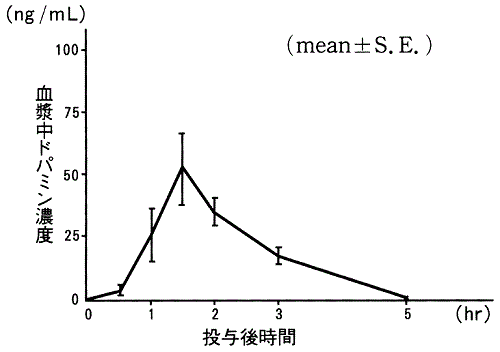
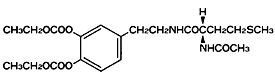
1
Yoshikawa M, et al.: Drug Metab Dispos. 1990; 18(2): 212-217
2
吉川正美, 他: 薬物動態. 1991; 6(2): 243-257
3
遠藤洋, 他: 薬物動態. 1991; 6(2): 277-284
4
Yoshikawa M, et al.: J Pharmacobiodyn. 1990; 13(4): 246-253
5
久萬田俊明, 他: 臨床医薬. 1991; 7(7): 1521-1542
6
Nishiyama S, et al.: J Cardiovasc Pharmacol. 1991; 17(4): 560-567
7
Nishiyama S, et al.: J Cardiovasc Pharmacol. 1990; 15(2): 283-290
8
Yamaguchi I, et al.: J Cardiovasc Pharmacol. 1989; 13(6): 879-886
9
西山信右, 他: 応用薬理. 1991; 41(5): 451-459