1
Stewart, W. C. et al.:Am J Ophthalmol.2001;131(3):339-344.
2
Herndon, L. W. et al.:Arch Ophthalmol.2002;120(6):847-849.
3
山本哲也 ほか:あたらしい眼科.2016;33(9):1369-1375.
4
Kudo, S. et al.:Eur J Clin Pharmacol.1997;52(6):479-485.
5
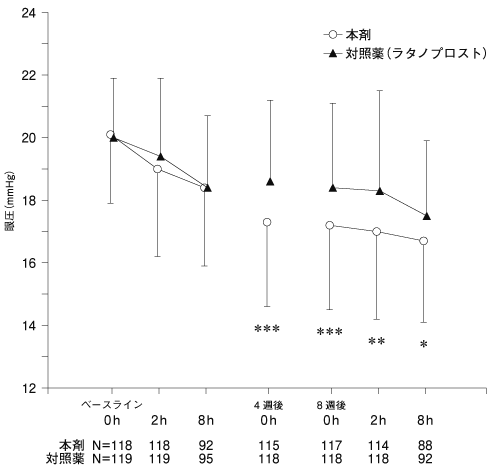
社内資料:ラタノプロスト点眼液との比較試験(2016年9月28日承認、CTD2.7.6.2)
6
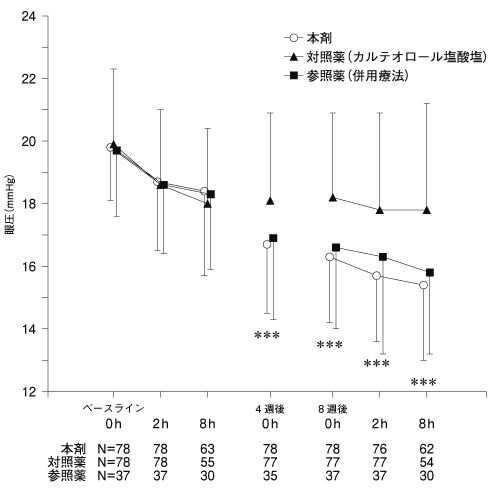
社内資料:カルテオロール塩酸塩持続性点眼液との比較試験(2016年9月28日承認、CTD2.7.6.2)
7
Yabuuchi, Y. et al.:Jpn J Pharmacol.1974;24(6):853-861.
8
新家 真 ほか:日本眼科学会雑誌. 1980;84(12):2085-2091.
9
松生俊和 ほか:眼科臨床医報.1983;77(10):1654-1657.
10
Stjernschantz, J. et al.:Adv Prostaglandin Thromboxane Leukot Res.1995;23:513-518.
11
高松倫也 ほか:新薬と臨床.1996;45(1):76-82.
12
社内資料:ウサギにおける眼圧上昇抑制作用(ミケランLA点眼液:2007年4月18日承認、CTD2.6.2.2)
13
渡辺耕三 ほか:応用薬理.1983;26(1):1-8.
14
Serle, J. B. et al.:Jpn J Ophthalmol.1998;42(2):95-100.
15
梅田和志 ほか:あたらしい眼科.2013;30(3):405-408.