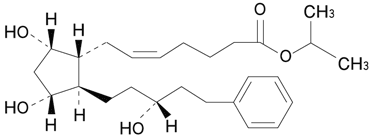
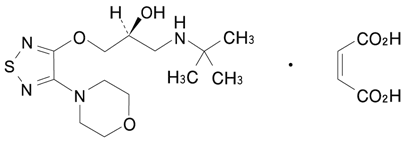
1
反復点眼後の血漿中ラタノプロスト遊離酸及びチモロールの薬物動態(ザラカム配合点眼液:2010年1月20日承認、申請資料概要2.7.6.2)
2
外国人健康成人における血漿中薬物動態の検討(ザラカム配合点眼液:2010年1月20日承認、審査報告書)
3
Calissendorff,B.et al.:J.Ocul.Pharmacol.Ther.2002;18(2):127-131
4
日本人患者を対象としたブリッジング試験(チモロール マレイン酸塩0.5%点眼液との比較試験)(ザラカム配合点眼液:2010年1月20日承認、申請資料概要2.7.6.9)
5
北澤克明ほか:臨床眼科.2009;63(5):807-815
6
外国人患者を対象とした第Ⅲ相臨床試験(ラタノプロスト0.005%点眼液及びチモロールマレイン酸塩0.5%点眼液との比較試験)(ザラカム配合点眼液:2010年1月20日承認、申請資料概要2.7.6.10)
7
外国人患者を対象とした第Ⅲ相臨床試験(ラタノプロスト0.005%点眼液及びチモロールマレイン酸塩0.5%点眼液の併用療法との比較試験)(ザラカム配合点眼液:2010年1月20日承認、申請資料概要2.7.6.15)
8
ラタノプロストとチモロールマレイン酸塩の併用療法を比較した第Ⅲ相試験(ザラカム配合点眼液:2010年1月20日承認、申請資料概要2.7.3.3.2)
9
野村俊治ほか:日本薬理学雑誌.2000;115:280-286
10
高松倫也ほか:新薬と臨床.1996;45(1):76-82
11
Miichi H.et al.:Invest.Ophthalmol.Vis. Sci.1983;24(9):1269-1275
12
新家真ほか:日本眼科学会雑誌.1980;84(10):1436-1446
13
藤永豊ほか:眼科臨床医報.1980;74(4):409-414
14
玉田康房ほか:日本眼科紀要.1980;31(10):1667-1673
15
三嶋弘ほか:基礎と臨床.1995;29(16):4271-4285
16
三嶋弘ほか:眼科臨床医報.1996;90(4):465-469
17
三嶋弘ほか:基礎と臨床.1995;29(16):4071-4084
18
三嶋弘ほか:基礎と臨床.1995;29(16):4085-4099
19
三嶋弘ほか:眼科臨床医報.1996;90(3):312-316
20
Vareilles,P.et al.:Invest.Ophthalmol.Vis.Sci.1977;16(11):987-996