1
Brown K, et. al.:Pharmacol Res Perspect. 2018;6(5):e00418
2
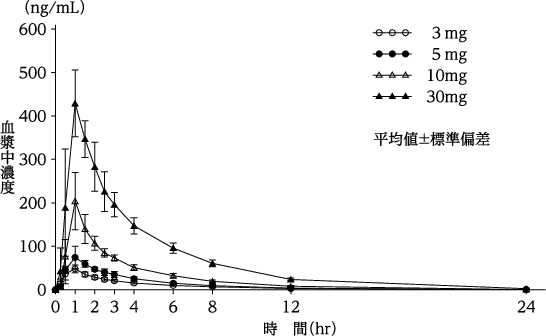
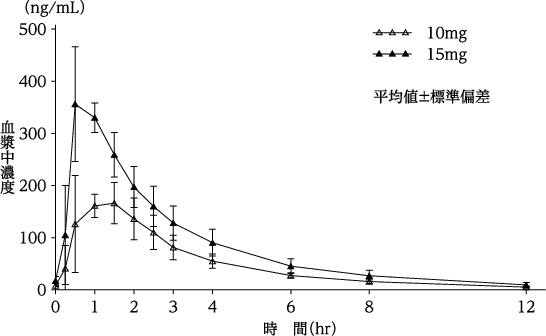
社内資料:単回投与時の薬物動態パラメータ(2019年1月8日承認、CTD2.7.6.3)
3
社内資料:ミロガバリンOD錠とミロガバリン錠の生物学的同等性試験
4
Jansen M, et al.:Clin Pharmacol Drug Dev. 2018;7(6):661-669
5
社内資料:反復投与時の薬物動態パラメータ(2019年1月8日承認、CTD2.7.6.5)
6
社内資料:空腹時又は食後投与時の薬物動態パラメータ(2019年1月8日承認、CTD2.7.6.2)
7
社内資料:14C標識体を用いた非臨床薬物動態試験(2019年1月8日承認、CTD2.6.4.4)
8
Yamamura N, et al.:Xenobiotica. 2021;51(5):549-563
9
社内資料:14C標識体を用いたヒトマスバランス試験(2019年1月8日承認、CTD2.7.6.4)
10
Kato M, et al.:J Clin Pharmacol. 2018;58(1):57-63
11
社内資料:日本人腎機能障害患者における薬物動態(2019年1月8日承認、CTD2.7.2.3.2.5)
12
Duchin K, et al.:Clin Drug Investig. 2018;38(11):1001-1009
13
社内資料:健康高齢者を対象とした反復投与試験(2019年1月8日承認、CTD2.7.6.7)
14
Tachibana M, et al.:Br J Clin Pharmacol. 2018;84(10):2317-2324
15
Jansen M, et al.:Clin Pharmacol Drug Dev. 2018;7(6):597-612
16
Baba M, et al.:J Diabetes Investig. 2019;10(5):1299-1306
17
社内資料:糖尿病性末梢神経障害性疼痛患者を対象とした第Ⅲ相国際共同臨床試験(プラセボ対照試験)(2019年1月8日承認、CTD2.7.6.21)
18
Kato J, et al.:Pain. 2019;160(5):1175-1185
19
社内資料:帯状疱疹後神経痛患者を対象とした第Ⅲ相国際共同臨床試験(プラセボ対照試験)(2019年1月8日承認、CTD2.7.6.22)
20
Baba M, et al.:J Diabetes Investig. 2020;11(3):693-698
21
社内資料:糖尿病性末梢神経障害性疼痛患者を対象とした第Ⅲ相国際共同臨床試験(長期投与試験)(2019年1月8日承認、CTD2.7.6.24)
22
Kato J, et al.:Medicine(baltimore). 2020;99(36):e21976
23
社内資料:帯状疱疹後神経痛患者を対象とした第Ⅲ相国際共同臨床試験(長期投与試験)(2019年1月8日承認、CTD2.7.6.25)
24
社内資料:中枢性神経障害性疼痛患者を対象とした第Ⅲ相国際共同臨床試験(プラセボ対照試験)(2022年3月28日承認、CTD2.7.6.1)
25
社内資料:中枢性神経障害性疼痛患者を対象とした第Ⅲ相国際共同臨床試験(長期投与試験)(2022年3月28日承認、CTD2.7.6.2)
26
Baba M, et al.:J Pain Res. 2020;13:1811-1821
27
社内資料:腎機能低下を有する糖尿病性末梢神経障害性疼痛又は帯状疱疹後神経痛患者を対象とした第Ⅲ相国内臨床試験(2019年1月8日承認、CTD2.7.6.26)
28
Domon Y, et al.:J Pharmacol Exp Ther. 2018;365(3):573-582
29
Kitano Y, et al.:Pharmazie. 2019;74(3):147-149
30
Oyama M, et al.:J Pharmacol Sci. 2021;146:33-39
31
Domon Y, et al.:Pharmazie. 2018;73(11):659-661