1
飯田順三他:精神科治療学, 1990;5:87-91
2
西嶋康一他:精神神経学雑誌, 1989;91:429-456
3
宮田純一他:救急医学, 1988;12:1813-1816
4
村崎光邦他:臨床評価, 1985;13:813-861
5
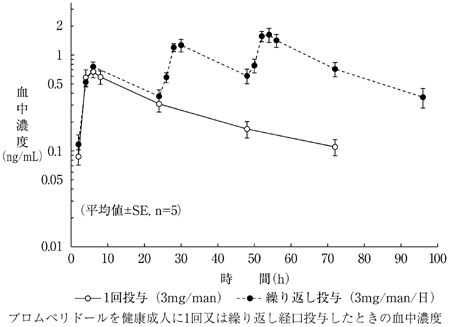
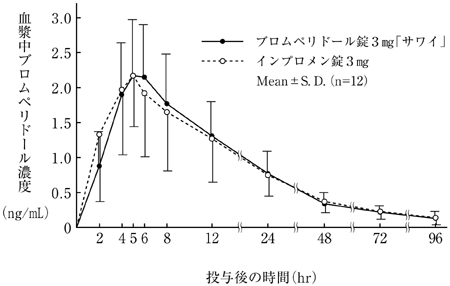
社内資料:生物学的同等性試験(錠3mg)
6
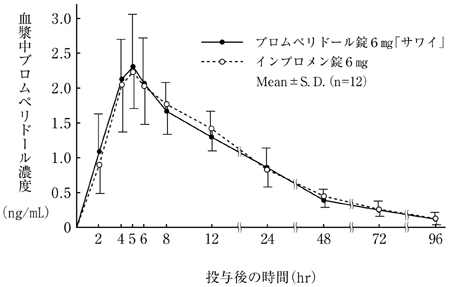
社内資料:生物学的同等性試験(錠6mg)
7
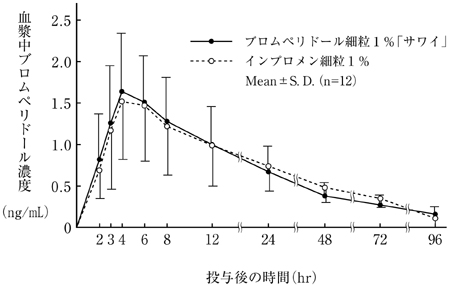
社内資料:生物学的同等性試験(細粒1%)
8
社内資料:生物学的同等性試験(錠1mg)
9
小澤光他編:薬物療法の実際第3版 第2編 薬のまとめ, 1986;71
10
Niemegeers, C. J. E. et al.:Arzneim. Forsch., 1974;24:45-52
11
大阪府病院薬剤師会編:医薬品要覧第5版, 1992:236-237