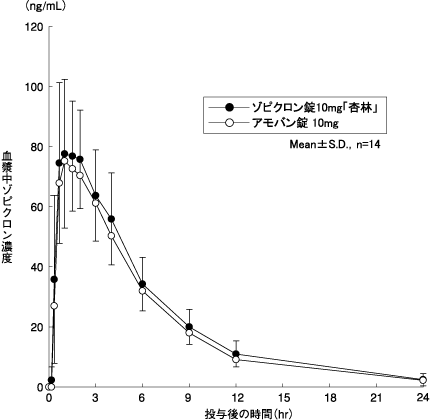
1
キョーリンリメディオ株式会社社内資料:
ゾピクロン錠7.5mg「杏林」・10mg「杏林」の生物学的同等性試験に関する資料
ゾピクロン錠7.5mg「杏林」・10mg「杏林」の生物学的同等性試験に関する資料
2
J.C.Blanchard,et al.:Int.Pharmacopsychiatry.1982;17(S-2):59-69/Pharmacology.1983;27(S-2):59-69
有効成分 | 日局ゾピクロン 7.5mg |
|---|---|
添加剤 | 無水リン酸水素カルシウム、乳糖水和物、ポビドン、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール、タルク、酸化チタン、カルナウバロウ |
有効成分 | 日局ゾピクロン 10mg |
|---|---|
添加剤 | 無水リン酸水素カルシウム、D-マンニトール、セルロース、ヒドロキシプロピルセルロース、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール、タルク、酸化チタン、カルナウバロウ |
| 剤形 | 割線入り皮膜錠 |
|---|---|
| 色調 | 白色 |
| 外形 |  |
| 大きさ | 大きさ(直径) 7.6mm 大きさ(厚さ) 3.2mm |
| 質量 | 175mg |
| 識別コード | PH124 |
| 剤形 | 割線入り皮膜錠 |
|---|---|
| 色調 | 白色 |
| 外形 |  |
| 大きさ | 大きさ(直径) 8.2mm 大きさ(厚さ) 3.5mm |
| 質量 | 200mg |
| 識別コード | PH125 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
筋弛緩薬 (スキサメトニウム塩化物水和物、ツボクラリン塩化物塩酸塩水和物、パンクロニウム臭化物) 中枢神経抑制剤 (フェノチアジン誘導体、バルビツール酸誘導体等) | これらの作用が増強されることがあるので、併用しないことが望ましいが、やむを得ず投与する場合には慎重に投与すること。 | 相加的に抗痙攣作用、中枢神経抑制作用が増強される可能性がある。 |
アルコール (飲酒) | 相互に作用を増強することがある。 | 飲酒により中枢神経抑制作用が増強されることがある。 |
麻酔時 | 呼吸抑制があらわれることがあるので、慎重に投与すること。 | 本剤により呼吸抑制があらわれることがあり、麻酔により相加的に呼吸が抑制される可能性がある。 |
薬物代謝酵素CYP3A4を誘導する薬剤 (リファンピシン等) | 本剤の作用を減弱させることがある。 | これらの薬剤の肝代謝酵素誘導作用により、本剤の代謝が促進され、効果の減弱を来すことがある。 |
薬物代謝酵素CYP3A4を阻害する薬剤 (エリスロマイシン、イトラコナゾール等) | 本剤の作用を増強させることがある。 | これらの薬剤の肝代謝酵素阻害作用により、本剤の代謝が阻害され、本剤の血漿中濃度が増加するおそれがある。 |
1%以上 | 0.1~1%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|---|
精神神経系 | ふらつき、眠気、頭重、頭痛 | 不快感、めまい等 | 錯感覚 | |
肝臓 | ALTの上昇 | ASTの上昇、Al-Pの上昇 | ||
腎臓 | 蛋白尿 | BUNの上昇 | ||
血液 | 白血球減少、ヘモグロビン減少、赤血球減少 | 血小板減少 | ||
消化器 | 口中のにがみ(8.06%)、口渇 | 嘔気、食欲不振、口内不快感、胃部不快感等 | 消化不良 | |
過敏症 | 発疹 | そう痒症 | ||
骨格筋 | だるさ | 倦怠感 | 脱力感等の筋緊張低下症状 | |
その他 | 転倒 |
判定パラメータ | ||
AUC0-24 (ng・h/mL) | Cmax (ng/mL) | |
ゾピクロン錠7.5mg「杏林」 | 452.8±92.1 | 73.59±11.83 |
アモバン錠7.5 | 471.0±87.6 | 78.59±23.94 |

判定パラメータ | ||
AUC0-24 (ng・h/mL) | Cmax (ng/mL) | |
ゾピクロン錠10mg「杏林」 | 552.0±139.7 | 88.46±15.72 |
アモバン錠10 | 502.4±122.6 | 85.75±23.86 |