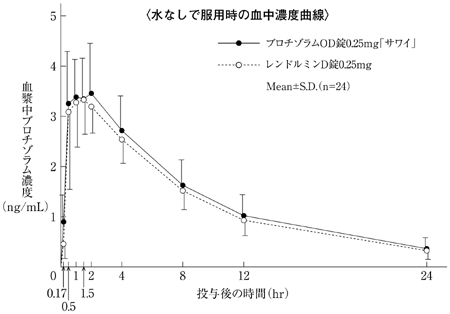
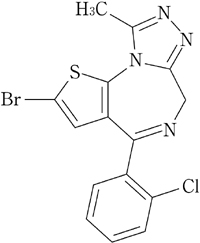
1
Hewett, C. et al.:Arzneimittelforschung, 1986:36:592-596
2
関野久邦他:新薬と臨牀, 2002;51:480-488
3
陶易王他:診療と新薬, 2009;46(3):290-300
4
吉田剛他:薬理と治療, 1985;13:3333-3344
5
Bechtel, W. D.:Br. J. Clin. Pharmacol., 1983;16(Suppl.2):261S-266S
6
Senda, C. et al.:Xenobiotica, 1997;27(9):913-922
7
Bechtel, W. D.:Br. J. Clin. Pharmacol., 1983;16(Suppl.2):279S-283S
8
筒井末春他:医学のあゆみ, 1984;131:412-427
9
村田忠良他:臨床精神医学, 1985;14:121-130
10
工藤義雄他:医学のあゆみ, 1985;134:494-515
11
稲永和豊他:薬理と治療, 1984;12:5111-5131
12
山村秀夫他:臨牀と研究, 1985;62:1924-1930
13
吉武潤一他:Therapeutic Research, 1984;1:829-838
14
山下格他:新薬と臨牀, 1984;33:1717-1734
15
稲永和豊他:薬理と治療, 1984;12:3769-3781
16
吉武潤一他:基礎と臨床, 1985;19:783-788
17
青野一哉他:臨牀と研究, 1984;61:3692-3696
18
筒井末春他:医学と薬学, 1983;10:1457-1472
19
筒井末春他:診療と新薬, 1985;22:41-56
20
村田忠良他:薬理と治療, 1984;12:5085-5100
21
稲永和豊他:新薬と臨牀, 1984;33:1135-1143
22
山村秀夫他:医学と薬学, 1985;13:227-236
23
吉武潤一他:薬理と治療, 1984;12:5101-5110
24
筒井末春他:医学と薬学, 1985;13:143-158
25
阿部裕他:新薬と臨牀, 1985;34:40-56
26
川上澄他:薬理と治療, 1984;12:5585-5602
27
中川哲也他:診療と新薬, 1985;22:333-343
28
工藤義雄他:診療と新薬, 1984;21:2255-2270
29
狭間秀文他:新薬と臨牀, 1985;34:29-39
30
森温理他:診療と新薬, 1984;21:2581-2594
31
Ishiko, J. et al.:Neuropharmacology, 1983;22:221-226
32
Kuhn, F. J. et al.:Br. J. Clin. Pharmacol., 1983;16(Suppl.2):253S-260S
33
Kimishima, K. et al.:Jpn. J. Pharmacol., 1984;36:461-475
34
Ueki, S. et al.:Jpn. J. Pharmacol., 1984;35:287-299
35
花岡一雄他:臨床薬理, 1983;14:365-377
36
大川敏彦他:臨床精神医学, 1984;13:749-760
37
Nicholson, A. N.:Br. J. Clin. Pharmacol., 1980;10:75-81
38
金英道他:臨床精神医学, 1991;20:55-63