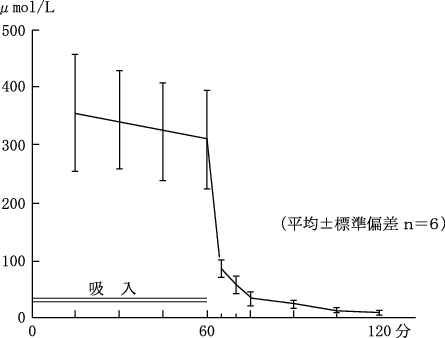
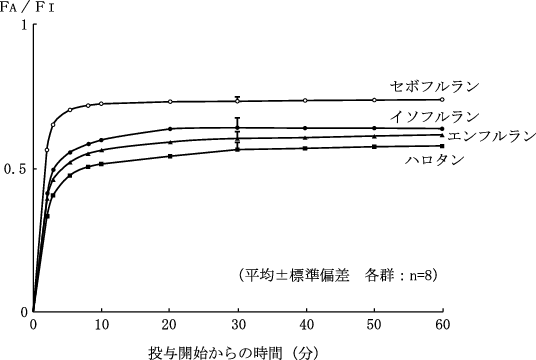
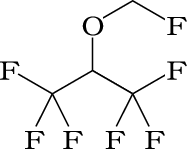
1
Navarro,R.,et al.:Anesthesiology, 1994; 80(3):545-549
2
池田和之 他:麻酔, 1986; 35(9増):S91
3
藤井宏融 他:麻酔, 1986; 35(9増):S373
4
Shiraishi,Y.,et al.:J.Clin.Anesth., 1990; 2(6):381-386
5
社内資料:日興製薬株式会社
6
第十八改正日本薬局方解説書 C-2958-2963,廣川書店,2021
7
Katoh,T.,et al.:Anesthesiology, 1987; 66(3):301-303
8
稲田 豊 他:麻酔, 1987; 36(6):875-889
9
Katoh,T.,et al.:Br.J.Anaesth, 1992; 68(2):139-141
10
Nakajima,R.,et al.:Br.J.Anaesth, 1993; 70(3):273-275
11
Doi M.,et al.: Can J Anaesth., 1993 ; 40(2) : 122-126
12
Avramov,M.N.,et al.:J.Anesth., 1987 Mar1; 1(1):1-7
13
太城力良 他:新薬と臨床, 1987; 36(2):194-198
14
Imamura,S.,et al.:J.Anesth., 1987 Mar1; 1(1):62-68
15
今村 聡 他:静岡県立総合病院医学雑誌, 1988; 4(1):19-22
16
Doi,M.,et al.:Anesth.Analg., 1987; 66(3):241-244