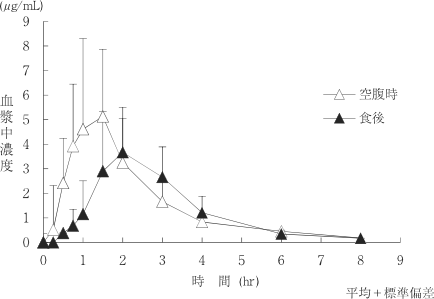
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き[20200928-1001]
2
岡本雅春ら:Chemotherapy 1994; 42(S-1): 161-173[11111112-3412]
3
岡本雅春ら:応用薬理 1994; 47(2): 139-145[11111112-3381]
4
金井 靖ら:薬理と治療 1997; 25(9): 2343-2346[11111112-3519]
5
藤谷朝通ら:薬理と治療 1997; 25(7): 1781-1799[11111112-3390]
6
杉山和志ら:Chemotherapy 1994; 42(S-1): 101-114[11111112-3392]
7
岡本雅春ら:薬理と治療 1998; 26(1): 13-21[11111112-3391]
8
釜田 悟ら:Chemotherapy 1994; 42(S-1): 131-160[11111112-3393]
9
中島光好ら:Chemotherapy 1993; 41(12): 1277-1292[11111112-3394]
10
岩垣明隆ら:Chemotherapy 1994; 42(S-1): 389-399[11111112-3422]
11
佐々木次郎ら:Chemotherapy 1994; 42(S-1): 642-655[11111112-3398]
12
荒田次郎ら:Chemotherapy 1994; 42(S-1): 503-522[11111112-3399]
13
馬場駿吉ら:耳鼻と臨床 1994; 40(3): 479-487[11111112-3400]
14
松田静治ら:Chemotherapy 1994; 42(4): 421-429[11111112-3387]
15
松田静治ら:Pharma medica 1997; 15(4): 155-166[11111112-3403]
16
原 二郎ら:Chemotherapy 1994; 42(S-1): 639-641[11111112-3401]
17
斎藤 功ら:Chemotherapy 1994; 42(S-1): 427-436[11111112-3402]
18
松本文夫ら:Chemotherapy 1994; 42(S-1): 339-344[11111112-3395]
19
柴 孝也ら:日本化学療法学会雑誌 2002; 50(10): 640-645[11111112-3428]
20
斎藤 厚ら:Chemotherapy 1994; 42(5): 616-638[11111112-3404]
21
荒川創一ら:西日本泌尿器科 1994; 56: 300-319[11111112-3406]
22
荒田次郎ら:Chemotherapy 1994; 42(6): 740-760[11111112-3405]
23
横田 健ら:Chemotherapy 1994; 42(S-1): 13-24[11111112-3408]
24
西野武志ら:Chemotherapy 1994; 42(S-1): 51-71[11111112-3411]
25
井上栄子ら:Chemotherapy 1994; 42(S-1): 1-12[11111112-3407]
26
那須孝昭ら:Chemotherapy 1994; 42(S-1): 25-37[11111112-3397]
27
永平和広ら:Chemotherapy 1994; 42(S-1): 38-50[11111112-3410]






 F15
F15